Forschungsgebiete
Molekulare Mechanismen der nicht-genotropen Aldosteronwirkung
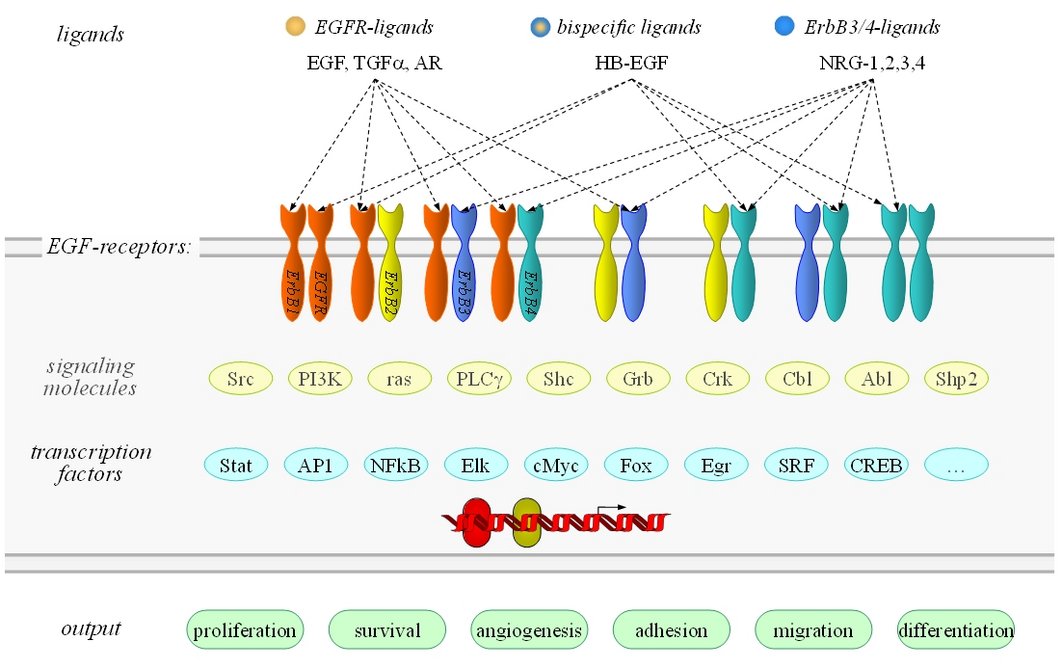
Aldosteron spielt eine wichtige Rolle bei der Regulation von Salz- und Wasserhaushalt sowie bei pathologischen kardiovaskulären und renalen Veränderungen. Wie für andere Steroide wurden für Aldosteron Effekte beschrieben, die nicht auf einem direkten genomischen Mechanismus beruhen. Es liegt also ein dualer Wirkmechanismus vor: genomisch und nicht-genotrop. Wie auch von uns gezeigt, werden nicht-genotrope Effekte teilweise durch den klassischen humanen Mineralokortikoid-Rezeptor (hMR) vermittelt und hängen vom „Crosstalk“ mit dem Epidermal Growth Factor-Rezeptor (EGFR) ab. hMR benutzt EGFR als heterologes Signaltransduktionssystem. Wir wollen die Rolle der verschiedenen Domänen des klassischen hMR bezüglich nicht-genotroper Wirkungen auf molekularer Ebene charakterisieren sowie deren Interaktion mit EGF-Rezeptoren untersuchen. Weiterhin werden wir die transkriptionelle Bedeutung nicht-genotroper Signale mit geeigneten Konstrukten testen sowie die Beeinflussung der genomischen Wirkung durch Signale des nicht-genotropen Weges untersuchen. Zu diesem Zweck verwenden wir heterologe Expressionssysteme mit geeigneten hMR-Konstrukten und humanen EGF-Rezeptoren.
Aldosteron-induzierte Expression des EGF-Rezeptors
Aldosteron führt am Herzen, an Gefäßen sowie an der Niere zu pathologischen Gewebe-veränderungen, wie Fibrose und Entzündung. Diese Rolle wird durch die klinische RALES-Studie unterstützt, die zeigt, dass Aldosteronantagonisten die Mortalitätsrate bei Herzinsuffizienz senken. Die beteiligten Vorgänge sind unklar. Somit besteht Handlungs-bedarf bezüglich Aufklärung der Mechanismen dieser pathologischen Aldosteronwirkung. Da wachstumsfaktor- und zytokintypische Signalwege wahrscheinlich eine Rolle spielen, stellt die Wechselwirkung von Aldosteron mit dem epidermalen Wachstumsfaktor (EGF) einen attraktiven Erklärungsansatz dar: (i) EGF fördert proliferative und fibrotische Veränderungen an kardiovaskulärem und renalem Gewebe. (ii) Bei Tieren mit mineralokortikoidinduzierter Hypertonie findet sich eine erhöhte vaskuläre EGF-Empfindlichkeit. (iii) Literaturdaten und unsere Vorversuche zeigen, dass Aldosteron die Expression des EGF-Rezeptors (EGFR) stimulieren kann. Diese Befunde stehen im Einklang mit oben genannter Hypothese und können zur Erklärung der pathologischen Wirkung von Aldosteron beitragen. In unserem Projekt sollen Mechanismen und Konsequenzen der mineralokortikoidrezeptorinduzierten EGFR-Expression untersucht werden.
Related articles:
2012
Schwerdt, G., Frisch, A., Mildenberger, S., Hilgenfeld, T., Grossmann, C., Gekle, M.: Influence of aldosterone and salt or ouabain in A10 rat aorta smooth muscle cells. J. Vasc. Res. 49(3), 231-241, 2012. [abstract]
2011
Schreier B, Rabe S, Schneider B, Ruhs S, Grossmann C, Hauptmann S, Blessing M, Neumann J, Gekle M.: Aldosterone/NaCl-induced renal and cardiac fibrosis is modulated by TGF-ß responsiveness of T cells. Hypertens Res. ;34(5):623-629,. 2011. [abstract]
Schreier B, Döhler M, Rabe S, Schneider B, Schwerdt G, Ruhs S, Sibilia M, Gotthardt M, Gekle M, Grossmann C.: Consequences of epidermal growth factor receptor (ErbB1) loss for vascular smooth muscle cells from mice with targeted deletion of ErbB1. Arterioscler. Thromb. Vasc. Biol. 31(7), 1643-1653, 2011. [abstract]
2010
Krug AW, Allenhöfer L, Monticone R, Spinetti G, Gekle M, Wang M, Lakatta EG. :Elevated mineralocorticoid receptor activity in aged rat vascular smooth muscle cells promotes a proinflammatory phenotype via extracellular signal-regulated kinase 1/2 mitogen-activated protein kinase and epidermal growth factor receptor-dependent pathways. Hypertension. ;55(6):1476-1483.2010. [abstract]
Grossmann C, Ruhs S, Seiferth A, Gekle M.: Interaction between mineralocorticoid receptor and cAMP/CREB signaling. Steroids; 75(8-9):539-543, 2010. [abstract]
Grossmann C, Wuttke M, Ruhs S, Seiferth A, Mildenberger S, Rabe S, Schwerdt G, Gekle M.: Mineralocorticoid receptor inhibits CREB signaling by calcineurin activation. FASEB J. 24(6), 2010-2019, 2010. [abstract]
Grossmann C, Husse B, Mildenberger S, Schreier B, Schuman K, Gekle M.: Colocalization of mineralocorticoid and EGF receptor at the plasma membrane. Biochim Biophys Acta. ; 1803(5):584-590. 2010. [abstract]
2009
Grossmann C, Gekle M.: New aspects of rapid aldosterone signaling. Mol Cell Endocrinol. ; 308(1-2):53-62. 2009 Review [abstract]
Gekle, M and C. Grossmann. Actions of aldosterone in the cardiovascular system: the good, the bad, and the ugly? Pflugers Arch. 458(2):231-46. 2009. [abstract]
2008
Grossmann C. and M. Gekle. Nongenotropic aldosterone effects and the EGFR: interaction and biological relevance. Steroids 73, 973-978, 2008 [abstract]
Grossmann, C., R. Freudinger, S. Mildenberger, B. Husse and M. Gekle. EF domains are sufficient for nongenomic mineralocorticoid receptor actions. J. Biol. Chem. 283(11), 7109-7116, 2008 [abstract]
2007
Husse, B., W. Briest, L. Homagk, G. Isenberg and M. Gekle. Cyclical mechanical stretch modulates expression of collagen I and collagen III by PKC and tyrosine kinase in cardiac fibroblasts. Am. J. Physiol. Regul. Integr. Comp. Physiol. 293, R1898-R1907, 2007 [abstract]
Krug; AW, S. Kopprasch, CG. Ziegler, S. Dippong, RA. Catar, SR. Bornstein, H. Morawietz and M. Gekle. Aldosterone rapidly induces leukocyte adhesion to endothelial cells: a new link between aldosterone and arteriosclerosis? Hypertension 50(5), e156-e157, 2007 [abstract]
Grossmann C. and M. Gekle. Non-classical actions of the mineralocorticoid receptor: misuse of EGF receptors? Mol. Cell Endocrinol. 277, 6-12, 2007 [abstract]
Grossmann, C., AW. Krug, R. Freudinger, S. Mildenberger, K. Voelker and M. Gekle. Aldosterone-induced EGFR expression: interaction between the human mineralocorticoid receptor and the human EGFR promoter. Am. J. Physiol. Endocrinol. Metab. 292, E1790-E1800, 2007 [abstract]
Grossmann, C., Krug, AW., Freudinger, R., Mildenberger, S., Volker, K: and Gekle, M. Aldosterone-induced epidermal growth factor receptor (EGFR) expression: Interaction betweenthe human mineralocorticoid receptor and the human EGFR promotor. Am. J. Physiol. Endocrinol. Metab., 2007 [abstract]
Gekle, M., Mildenberger, S., Freudinger, R. and Grossmann, C. Altered collagen homeostasis in human aortic smooth muscle cells (HAoSMC) induced by aldosterone. Plügers Arch., 2007 [abstract]
Pfau, A., C. Grossmann, R. Freudinger, S. Mildenberger, A. Benesic and M. Gekle. Ca2+ but not H2O2 modulates GRE-element activation by the human mineralocorticoid receptor in HEK cells. Mol. Cell. Endocinol. 264, 35-43, 2007 [abstract]
2006
Drumm, K., T.R. Kress, B. Gassner, A.W. Krug and M. Gekle. Aldosterone stimulates activity and surface expression of NHE3 in human primary renal proximal tubule cells (RPTEC). Cell. Physiol. Biochem. 17, 21-28, 2006 [abstract]
2005
Grossmann, C., A. Benesic, A.W. Krug, R. Freudinger, S. Mildenberger, B. Gassner and M. Gekle. Human mineralocorticoid receptor expression renders cells responsive for nongenotropic aldosterone actions. Mol. Endocrinol. 19, 1697-1710, 2005 [abstract]
2004
Grossmann, C., R. Freudinger, S. Mildenberger, A.W. Krug and M. Gekle. Evidence for epidermal growth factor receptor as negative-feedback control in aldosterone-induced Na+ reabsorption. Am. J. Physiol. Renal Physiol. 286, F1226-F1231, 2004 [abstract]
2003
Krug, AW., C. Grossmann, C. Schuster, R. Freudinger, S. Mildenberger, MV. Govindan and M. Gekle. Aldosterone stimulates epidermal growth factor receptor expression. J. Biol. Chem. 278, 43060-43066, 2003 [abstract]
Krug, AW., F. Papavassiliou, U. Hopfer, KJ. Ulrich and M. Gekle. Aldosterone stimulates surface expression of NHE3 in renal proximal brush borders. Pflügers Arch. 446, 492-496, 2003 [abstract]
2002
Krug, AW., C. Schuster, B. Gassner, R. Freudinger, S. Mildenberger, J. Troppmair and M. Gekle. Human EGF receptor 1 (HER1) renders CHO cells sensitive to alternative aldosterone signaling. J. Biol. Chem., 277 (48), 45892-45897, 2002 [abstract]
Gekle, M., R. Freudinger, S. Mildenberger and S. Silbernagl. Rapid actions of aldosterone on cells from renal epithelium: the possible role of EGF-receptor signaling. Steroids 67, 499-504, 2002 [abstract]
Gekle, M., R. Freudinger, S. Mildenberger and S. Silbernagl. Aldosterone interaction with epidermal growth factor receptor signaling in MDCK cells. Am. J. Physiol. Renal Physiol. 282, F669-F679, 2002 [abstract]
2001
Gekle, M., R. Freudinger, S. Mildenberger, K. Schenk, I. Marschitz and H. Schramek. Rapid activation of Na+/H+-exchange in MDCK cells by aldosterone involves MAP-kinases ERK1/2. Pflügers Arch. - Eur. J. Physiol. 441, 781-786, 2001 [article]
1998
Gekle, M., S. Silbernagl and S. Wünsch. Non-genomic action of the mineralocoticoid aldosterone on cytosolic sodium in cultured kidney cells. J. Physiol. (Lond) 511, 255-263, 1998 [abstract]
1997
Schneider, S.W., Y. Yano, B.E. Sumpio, B.P. Jena, J.P. Geibel, M. Gekle and H. Oberleithner. Rapid aldosterone-induced cell volume increase of endothelial cells measured by atomic force microscope. Cell Biol. Int. 21, 759-768, 1997 [abstract]
M. Gekle, S. Silbernagl and H. Oberleithner. The mineralocorticoid aldosterone activates a proton conductance in cultured kidney cells. Am. J. Physiol. 273, C1673-C1678, 1997 [abstract]
1996
Gekle, M., Golenhofen, N., Oberleithner, H., and Silbernagl, S. Rapid activation of Na+/H+-exchange by aldosterone in renal epithelial cells requires Ca2+ and stimulation of a plasma membrane proton conductance. Proc.Natl.Acad.Sci.USA 93, 10500-10504, 1996. [abstract]
Renokardiovaskuläre Erkrankungen zählen zu den häufigsten Todesursachen. Funktionelle Störungen der arteriellen Gefäßwand sind initiale Schlüsselereignisse bei Erkrankungen des Herzens, der Niere und auch des zentralen Nervensystems. Veränderungen der Gefäßwand betreffen neben der Einstellung des Gefäßtonus auch die Wandstruktur und deren adaptive Umwandlung bei pathophysiologischen Belastungen. Funktion und Morphologie von Gefäßen unterliegen der Kontrolle durch zahlreiche humorale und lokale Faktoren, die untereinander in Wechselwirkung stehende intrazelluläre Signalkaskaden beeinflussen, wobei das integrierte Ergebnis letztendlich die Veränderung der zellulären Funktion bestimmt. Die Aufklärung dieser Signalprozesse kann zu einem besseren Verständnis der Vorgänge innerhalb von Gefäßen führen und somit einen Beitrag zur Aufklärung möglicher Ursachen renokardiovaskulärer Erkrankungen leisten.
Im Rahmen dieses Projektes wird die Bedeutung des EGF-Rezeptors (EGFR) in Gefäßmuskelzellen unter physiologischen Bedingungen sowie bei pathologischen Regulations- und Adaptationsmechanismen des renokardiovaskulären Systems untersucht, da sich gezeigt hat, dass der EGFR eine Schlüsselposition innerhalb relevanter Signalkaskaden einnimmt. Es ist bekannt, dass der EGFR auch als Relaisstation für heterologe Signaltransduktion dient. In dieser Funktion wird der EGFR durch Signale aktiviert, die keine direkten Liganden für ihn darstellen, wie z.B. die Homone Angiotensin II, Aldosteron, Endothelin und deren Rezeptoren sowie Sauerstoffradikale oder mechanische Faktoren. Diese Transaktivierung ist wahrscheinlich essentiell für die Wirkung dieser Hormone im Rahmen eines überschießenden Wachstums von Gefäßzellen, deren Migration, Störungen der Bindegewebshomöostase aber auch der Gefäßfunktion per se. Dies bedeutet, dass physiologische und pathophysiologische Effekte im renokardiovaskulären System der EGFR-Transaktivierung bedürfen. Weiterhin gibt es Hinweise, dass der EGFR unter bestimmten Voraussetzungen protektive Wirkung im kardiovaskulären System entfaltet. Kontext-abhängig kann der EGFR somit im Sinne einer Janusköpfigkeit positiv oder negativ wirken.
Da die Beteiligung des EGFR an pathologischen Prozessen durch v.a. pharmakologische Studien ex vivo und in Zellkultur belegt ist, wurden für dieses Projekt zwei Mausmodelle mit Gefäßmuskelzell-spezifischer Deletion etabliert und partiell bereits charakterisiert (konstitutive Deletion und induzierbare Deletion). Mit dem Projekt sollen folgende Ziele erreicht werden: (i) Charakterisierung des Phänotyps der Tiere zur Beschreibung der zellspezifischen physiologischen Rolle des EGFR. (ii) Untersuchung der schädigenden Wirkungen vasoaktiver Substanzen (u.a. Angiotensin II und Aldosteron) in Abhängigkeit von der EGFR-Expression. Zu diesen Zwecken werden Studien auf drei Ebenen durchgeführt: (a) in vivo, (b) an isolierten Aortenringen und (c) an Gefäßmuskelzellen in Primärkultur. Die zu untersuchenden Zielparameter umfassen hämodynamische und renale Größen, Expression relevanter Gene, Gefäßmechanik, Phänotyp glatter Gefäßmuskelzellen, Wirkung vasoaktiver Substanzen sowie die Signaltransduktion über den EGFR im Sinne der Transaktivierung. Dadurch ist die Beurteilung der Rolle des glattmuskulären EGFR für die Gefäßhomöostase an sich sowie im Rahmen der Entstehung vaskulärer Schäden zellbiologisch und in vivo möglich.
Steroid hormone receptors are ligand-dependent transcription factors that control a variety of homeostatic functions, starting from salt metabolism to sexual behavior. It is now evident that steroid hormone receptors do not follow a simple on/off switch model, but depend on the interaction with different signaling networks. Although for some steroid hormone receptors information is available, for the mineralocorticoid receptor (MR) very little is known. The MR controls extracellular volume, long-term regulation of blood pressure and homeostatic behavior. MR also promotes renocardiovascular inflammation and fibrosis independently of blood pressure and salt homeostasis. As a ligand-dependent transcription factor, MR modulates the expression of proteins. Furthermore, MR interacts non-genomically with cytosolic signaling pathways, including calcium and protein kinases in different cell types. Its closest relative, the glucocorticoid receptor (GR), is important for e.g. development, glucose/lipid metabolism and immune function. Although the cellular and systemic effects of MR-activation are clearly distinct from GR-activation, the mechanism of their differential action is not understood. So far no mineralocorticoid-response element has been identified in promoters and most genes induced by MR are also induced by GR.
Control of miRNA expression by MR would offer an additional level of regulation which has not been investigated until today. This function could contribute to differential effects compared with its closest relative glucocorticoid receptors. In recent years the importance of altered miRNA expression for the renocardiovascular system has been shown and gains rapid growing consideration. Thus, our project is of basic and clinical relevance.
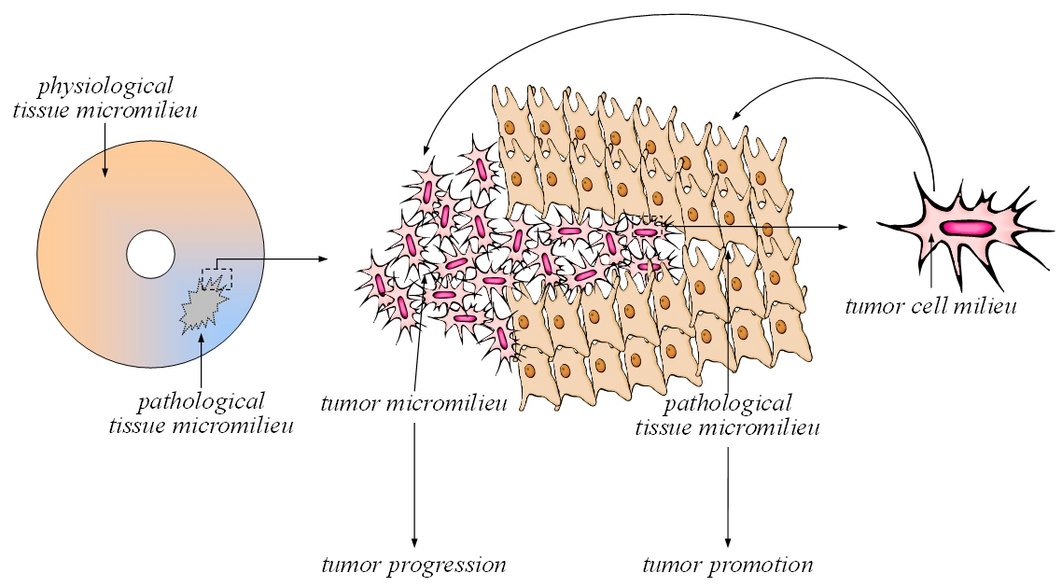
Der Phänotyp von Tumorzellen hängt - neben seiner genetischen Determiniertheit - zum Teil vom umgebenden und zum Teil von selbst kreierten Milieu ab. Die „seed and soil“-Hypothese geht sogar soweit, dass nach Erwerb aller kanzerösen genetischen Veränderungen erst die Änderung des Mikromilieus das Wachstum der Tumorzellen ermöglicht. Thema dieses Teilvorhabens ist die Charakterisierung von Milieu-Signal-Interaktionen an Tumorzellen als Grundlage für Weiterentwicklung rationaler, patientenindividualisierter Therapiestrategien in der Onkologie. Hierbei sollen relevante Proteinmodifikationen des Milieu-Signal-Dialoges identifiziert und als therapeutische Zielstruktur validiert werden. Der Fokus liegt dabei auf der Bedeutung des pH-Wertes im Mikromilieu und dessen Einfluss auf Proteinkinasen. Die Arbeiten befassen sich mit der molekularen Charakterisierung von Azidose-induzierten Signalwegen, der ablaufenden Modifikationen von Signalmodulen, deren funktionelle Relevanz für den Tumorphänotyp und dadurch die Identifikation neuer Therapiestrategien homöostatischer (Modifikation des Mikromilieus) oder funktioneller (Beeinflussung von Zielproteinen) Art. Ausgehend von den in diesem Vorhaben erarbeiteten Mechanismen und charakterisierten Schlüsselmolekülen soll die Wirkstoffweiterentwicklung unterstützt werden, so dass möglichst großer Nutzen bei möglichst geringen unerwünschten Wirkungen entsteht.
A lot of substances have nephrotoxic side effects and act as cell stressors as e.g. chemotherapeutica (cisplatin, metabolites of ifosfamide) or mycotoxins. Ochratoxin A (OTA) is a ubiquitous mycotoxin produced by some species of Aspergillus and Penicillium genus acting primarily on the kidney. It is detectable in human blood in low concentration due to normal diet. OTA is frequently supposed to be the causing agent of Balkan endemic nephropathy and of porcine nephropathy. The mechanism of the cell damaging action of these cell stressors often remains largely unknown.
Subject of our studies is:
- Altered gene expression in human renal cells induced by OTA
- Posttranscriptional regulation influenced by OTA and other cell stressors
- Transformation of epithelial cells by OTA and other nephrotoxins
- Cell death induced by OTA and other nephrotoxins (cisplatin, fumonisins)
- Transport of OTA across epithelia of the nephron and its uptake into cells studied on MDCK cells.
- Effects of OTA on carrier systems of cells of the proximal tubule (OK cells).
- Interaction of OTA with chloride channels and cellular pH-homeostasis
- Impairment of renal hemodynamics by OTA
- Impairment of proximal tubular function by OTA
- Impairment of the renal concentrating mechanism by OTA
- Impairment of urine acidification by OTA
- Interaction of OTA and other nephrotoxins with intracellular signaling pathways
- Cytotoxicity of ifosfamide and its metabolites chloroacetaldeyhde and acrolein on renal cells
- Interaction of ifosfamide and its metabolites with intracellular signaling
Related articles:
2021
Schwerdt G, Kopf M, Gekle M.: The Impact of the Nephrotoxin Ochratoxin A on Human Renal Cells Studied by a Novel Co-Culture Model Is Influenced by the Presence of Fibroblasts, Toxins (Basel), 13(3):219 [abstract]
2020
Dubourg V, Nolze A, Kopf M, Gekle M, Schwerdt G: Weighted Correlation Network Analysis Reveals CDK2 as a Regulator of a Ubiquitous Environmental Toxin-Induced Cell-Cycle Arrest. Cells, 9(1) 2020 [abstract]
2019
Schulz MC, Gekle M, Schwerdt G: Epithelial-fibroblast cross talk aggravates the impact of the nephrotoxin ochratoxin A. Biochim Biophys Acta Mol Cell Res., 1866(12):118528, 2019 [abstract]
2018
Schulz MC, Wagenbrett L, Schwerdt G, Gekle M: Influence of Extracellular Acidosis on Matrix Protein Homeostasis in Tumour Cells and Fibroblasts. Adv Exp Med Biol., 1072, 213-217, 2018 [abstract]
Schulz MC, Schumann L, Rottkord U, Humpf HU, Gekle M and Schwerdt G.: Synergistic action of the nephrotoxic mycotoxins ochratoxin A and citrinin at nanomolar concentrations in human proximal tubule-derived cells. Toxicol Lett.,291, 149-157, 2018 [abstract]
Polovic M, Dittmar S, Hennemeier I, Humpf HU, Seliger B, Fornara P, Theil G, Azinovic P, Nolze A, Köhn M, Schwerdt G and Gekle M.: Identification of a novel lncRNA induced by the nephrotoxin ochratoxin A and expressed in human renal tumor tissue. Cell Mol Life Sci.,75(12),2241-2256, 2018 [abstract]
2017
Rottkord, U., Röh, C., Ferse, I, Schulz, MC., Rückschloss, U., Gekle, M., Schwerdt, G. and Humpf, HU.: Structure-activity relationship of ochratoxin A and synthesized derivatives: importance of amino acid and halogen moiety for cytotoxicity.,Arch. Toxicol., 1461-1471, 2017 [abstract]
2014
Hennemeier, I., Humpf, H.U., Gekle, M. and Schwerdt, G.: Role of microRNA29-b in the ochratoxin A-induced enhanced collagen formation in human kidney cells. Toxicology, 324, 116-122, 2014 [abstract]
Benesic, A., Schwerdt, G., Hennemeier, I., Sauvant, C., Mildenberger, S. and Gekle, M.:The nephrotoxic ifosfamide-metabolite chloroacetaldehyde interferes with renal extracellular matrix homeostasis.Cell. Physiol. Biochem., 33, 1106-1116, 2014 [abstract]
Hennemeier, I., M. Gekle and G. Schwerdt: Stress-induced expression and function of the lng non-coding WISP1 transcript lncWISP1 in human renal cells. Acta Physiologica 210 Suppl. 695, 117, 2014
2013
Weidner M., M. Lenczyk, G. Schwerdt, M. Gekle and HU Humpf: Neurotoxic potential and cellular uptake of T-2 toxin in human astrocytes in primary culture. Chem Res Toxicol. 26 (3), 347-355, 2013 [abstract]
2012
Hennemeier, I., HU Humpf, M. Gekle and G. Schwerdt: The food contaminant and nephrotoxin ochratoxin A enhances Wnt1 inducible signaling protein 1 and tumor necrosis factor-α expression in human primary proximal tubule cells. Mol. Nutr. Food Res. 56 (9), 1375–1384, 2012 [abstract]
Weidner, M., T. Welsch, F. Hübner, G. Schwerdt, M. Gekle and HU Humpf: Identification and apoptotic potential of T-2 toxin metabolites in human cells. J. Agric. Food. Chem. 60 (22), 5676-5684, 2012 [abstract]
Hennemeier, I., M. Gekle and G. Schwerdt: Signaling pathways involved in ochratoxin A-induced expression of Wnt1 inducible signaling protein 1 in human kidney cells. Acta Physiologica 204 Suppl. 689, 264, 2012
2011
Hennemeier, I., M. Gekle and G. Schwerdt: Influence of ochratoxin A on gene expression in primary human proximal tubule cells. Acta Physiologica 201 Suppl. 682, 243, 2011
Hennemeier, I., M. Gekle and G. Schwerdt: Ochratoxin A influences the expression of genes involved in renal pathophysiology in primary human proximal tubule cells. Mycotoxin-Workshop Freising, 2011
2009
Königs, M., D. Mulac, G. Schwerdt, M. Gekle and HU Humpf: Metabolism and cytotoxic effects of T-2 toxin and its metabolites on human cells in primary culture. Toxicology 258(2-3), 106-115, 2009 [abstract]
Schwerdt, G., H. Holzinger, M. Königs, HU Humpf and M. Gekle: Effect of ochratoxin A on cell survival and collagen homeostasis in human mesangial cells in primary culture. Food Chem. Toxicol. 47 (1), 209-213, 2009 [abstract]
Schwerdt, G., M. Königs, H. Holzinger, HU Humpf and M. Gekle: Effects of the mycotoxin fumonisin B(1) on cell death in human kidney cells and human lung fibroblasts in primary culture. J. Appl. Toxicol. 29(2), 174-182, 2009 [abstract]
2008
Königs, M., G. Schwerdt, M. Gekle and H.U. Humpf: Effects of the mycotoxin deoxynivalenol on human primary hepatocytes. Mol. Nutr. Food Res. 52(7), 830-839, 2008 [abstract]
2007
Königs, M., M. Lenczyk, G. Schwerdt, H. Holzinger, M. Gekle and HU. Humpf: Cytotoxicity, metabolism and cellular uptake of the mycotoxin deoxynivalenol in human proximal tubule cells and lung fibroblasts in primary culture. Toxicology 240, 48-59, 2007 [abstract]
Schwerdt, G., A. Kirchhoff, R. Freudinger, B. Wollny, A. Benesic and M. Gekle: Mesna or cysteine prevents chloroacetaldehyde-induced cell death of human proximal tubule cells. Pediatr. Nephrol. 22 (6), 798-803, 2007 [abstract]
Schwerdt, G., H. Holzinger, C. Sauvant, M. Königs, HU. Humpf and M. Gekle: Long-term effects of ochratoxin A on fibrosis and cell death in human proximal tubule or fibroblast cells in primary culture. Toxicology 232, 57-67 [abstract]
2006
Benesic, A., G. Schwerdt, R. Freudinger, S. Mildenberger, F. Groezinger, B. Wollny, A. Kirchhoff and M. Gekle: Chloroacetaldehyde as a sulfhydryl reagent: the role of critical thiol groups in ifosfamide nephrotoxicity. Kidney and Blood Press Res. 29, 280-293 [abstract]
Schwerdt, G., N. Gordjani, A. Benesic, R. Freudinger, B. Wollny, A. Kirchhoff and M. Gekle: Chloroacetaldehyde- and acrolein-induced death of human proximal tubule cells. Pediatr. Nephrol. 21 (1), 60-67 [abstract]
2005
Benesic, A., G. Schwerdt, S. Mildenberger, R. Freudinger, N. Gordjani and M. Gekle: Disturbed Ca2+-signaling by chloroaecetaldehyde: A possible cause for chronic ifosfamide nephrotoxicity. Kidney Int. 68, 2029-2041 [abstract]
Sauvant, C., H. Holzinger and M. Gekle: Ochratoxin A induces typical signs of nephropathy in proximal tubular cells which are induced by a specific activation pattern of mitogen activiated protein kinases (ERK, JNK, and p38) and modulated by a prototypical anthocyanidin. Proceedings 27th Mycotoxin-Workshop, Dortmund 2005
Knecht, A., G. Schwerdt, M. Gekle and H.U. Humpf. Combinatory effects of citrinin and ochratoxin A in human proximal tubule cells. Proceedings 27th Mycotoxin-Workshop, Dortmund 2005
Schwerdt, G., R. Freudinger, C. Schuster, F. Weber, O. Thews and M. Gekle. Cisplatin-induced apoptosis is enhanced by hypoxia and by inhibition of mitochondria in renal collecting duct cells. Toxicol. Sci. 85, 735-742, 2005 [abstract]
Sauvant, C., H. Holzinger and M. Gekle. The nephrotoxin ochratoxin A induces key parameters of chronic interstitial nephropathy in renal proximal tubular cells. Cell. Physiol. Biochem. 15, 125-134, 2005 [abstract]
Weber, F., R. Freudinger, G. Schwerdt and M. Gekle. A rapid screening method to test apoptotic synergisms of ochratoxin A with other nephrotoxic substances.
Toxicol. in Vitro 19, 135-143, 2005 [abstract]
Gekle, M., C. Sauvant and G. Schwerdt. Ochratoxin A at nanomolar concentrations: A signal modulator in renal cells. Mol. Nutr. Food Res. 49, 118-130, 2005 [abstract]
Blazer-Yost, B.L., T.A. West, J. Stack, K. Peck, T.F. Lahr and M. Gekle. Effect of the mycotoxin ochratoxin A on hormone-stimulated ion transport in a cultured model of the renal principal cell. Pflügers Arch., 2005 [abstract]
Sauvant, C., H. Holzinger and M. Gekle. Proximal tubular toxicity of ochratoxin A is amplified by simulaneous inhibition of the extracellular regulated kinases 1/2.
J. Pharm. Exp. Ther., 313, 234-241, 2005 [abstract]
Sauvant, C., H. Holzinger, S. Mildenberger and M. Gekle. Exposure to nephrotoxic ochratoxin A enhances collagen secretion in human renal proximal tubular cells. Mol. Nutr. Food Res. 49, 31-37, 2005 [abstract]
2004
Weber, F., G. Schwerdt, R. Freudinger and M. Gekle. Programmed cell death by interaction of ochratoxin A with other nephrotoxins. Mycotox. Res. 19, 20-23, 2004
Schwerdt, G., R. Freudinger, C. Schuster, S. Silbernagl and M. Gekle. Inhibition of mitochondria and extracellular acidification enhance ochratoxin A-induced apoptosis in renal collecting duct-derived MDCK-C7 cells. Cell. Physiol. Biochem. 14, 47-56, 2004 [abstract]
Ludwig, T., C. Riethmüller, M. Gekle, G. Schwerdt and H. Oberleithner. Nephrotoxicity of platinum complexes is related to basolateral organic cation transport. Kidney Int. 66, 196-202, 2004 [abstract]
2003
Schwerdt, G., R. Freudinger, C. Schuster, S. Silbernagl and M. Gekle. Inhibition of mitochondria prevents cell death in
kidney epithelial cells by intra- and extracellular acidification. Kidney Int. 63, 1725-1735, 2003 [abstract]
Seefelder, W., H.U. Humpf, G. Schwerdt, R. Freudinger and M. Gekle. Induction of apoptosis in cultured human proximal tubule cells by fumonisins and fumonisin metabolites. Toxicol. Appl. Pharmacol. 192, 146-153, 2003 [abstract]
2002
Gekle, M., G. Schwerdt and C. Sauvant. Tubulotoxische Mechanismen am Beispiel von Ochratoxin A. Nieren und Hochdruckkrankheiten 31 (8), 324-328, 2002
Seefelder, W., G. Schwerdt, R. Freudinger, M. Gekle and H. U. Humpf. Liquid chromatography/electrospray ionisation-mass spectrometry method for the quantification of sphingosine and sphinganine in cell cultures exposed to fumonisins. J. Chromatogr. B. Analyt. Technol. Biomed. Life Sci. 780 , 137, 2002 [abstract]
2001
Schwerdt, G., R. Freudinger, C. Schuster, S. Silbernagl and M. Gekle. The role of mitochondria and extracellular pH in ochratoxin A-induced apoptosis of human proximale tubule cells. Pflügers Arch. Suppl. 441, R245, 2001 (poster)
Schwerdt, G, C. Schuster, S. Silbernagl, M. Gareis and Gekle, M. Preliminary results on ochratoxin A concentrations in blood of patients with various kidney diseases in Germany. Mycotoxin Res. 17A (2), 146-149, 2001 (Proceedings 23rd Mycotoxin-Workshop, Vienna 2001)
Schwerdt, G., F. Weber, R. Freudinger, C. Schuster, S. Silbernagl and M. Gekle. Effect of mitochondrial inhibition and extracellular pH on apoptosis of human proximal tubule cells. J. Am. Soc. Nephrol. 12, A3231, 2001 (poster)
2000
Benesic, A., S. Mildenberger and M. Gekle. Nephritogenic ochratoxin A interferes with hormonal signalling in immortalized human kidney epithelial cells. Pflügers Arch. 439, 278-287, 2000 [abstract]
Gekle, M., G. Schwerdt, R. Freudinger, S. Mildenberger, D. Wilfingseder, V. Pollack, M. Dander and H. Schramek. Ochratoxin A induces JNK activation and apoptosis in MDCK-C7 cells at nanomolar concentrations. J. Pharmacol. Exp. Ther. 293, 837-844, 2000 [abstract]
Eder, S., A. Benesic, R. Freudinger, J. Engert, G. Schwerdt, K. Drumm and M. Gekle. Nephritogenic ochratoxin A interferes with mitochondrial function and pH homeostasis in immortalized human kidney epithelial cells. Pflügers Arch. 440, 521-529, 2000 [abstract]
Schwerdt, G., R. Freudinger, C. Schuster, S. Silbernagl and M. Gekle. Apoptosis in cultured renal epithelial cells caused by ochratoxin A. Mycotoxin Research 16A, 154-157, 2000 (Proceedings 22nd Mycotoxin-Workshop Bonn 2000)
1999
Schwerdt, G., R. Freudinger, S. Silbernagl and M. Gekle. Ochratoxin A-binding proteins in rat organs and plasma and in different cell lines of the kidney. Toxicology 135, 1-10, 1999 [abstract]
Benesic, A., S. Eder, C. Sauvant, Schwerdt, G. and M. Gekle. Ochratoxin A induces proliferation of immortalized human kidney epithelial cells at low nanomolar concentrations by interference with cellular Ca2+-homeostasis. Proceedings 21st Mycotoxin-Workshop, Jena 130-138, 1999
Sauvant, C., S. Silbernagl and M. Gekle. Chronische Exposition von humanen Zellen des proximalen Tubulus mit nanomolaren Konzentrationen von freiem Ochratoxin A führt zu einer verminderten Expression des basolateralen Transportproteins für organische Anionen, OAT1 (Chronic exposure of human proximal tubule cells to nanomolar concentrations of free ochratoxin A leads to decreased expression of the basolateral anion transporter, OAT1) . Proceedings 21st Mycotoxin-Workshop, Jena 234-238, 1999
Schwerdt, G., R. Freudinger, S. Silbernagl and M. Gekle. Ochratoxin A-induzierte Expressionsänderungen des Tumorsuppressorproteins p53 in Zellen des humanen proximalen Tubulus (Ochratoxin A-induced changes in the expression of the p53 tumor suppressor protein in cells of the human proximal tubule) . Proceedings 21st Mycotoxin-Workshop, Jena 239-244, 1999
Gekle, M., S. Mildenberger, C. Sauvant, D. Bednarczyk, S.H. Wright and W.H. Dantzler. Inhibition of initial transport rate of basolateral organic anion carrier in renal PT by BK and phenylephrine. Am. J. Physiol. (Renal Physiology) 46, F251-F256, 1999 [abstract]
Schwerdt, G., R. Freudinger, S. Mildenberger, S. Silbernagl and Gekle, M. The nephrotoxin ochratoxin A induces apoptosis in human proximal tubule cells. Cell Biol. Toxicol. 15, 405-415, 1999 [abstract]
1998
Dahlmann, A., W.H. Dantzler, S. Silbernagl and M. Gekle. Detailed mapping of ochratoxin A reabsorption along the rat nephron in vivo: The nephrotoxin can be reabsorbed in all nephron segments by different mechanisms. J. Pharmacol. Exp. Ther. 286, 157-162, 1998 [abstract]
Gekle, M., C. Sauvant, G.Schwerdt and S. Silbernagl. Tubulotoxic mechanisms of ochratoxin A. Kidney Blood Press Res 21: 277-279, 1998 [abstract]
Gekle, M., B. Gassner, R. Freudinger, S. Mildenberger, S. Silbernagl, W. Pfaller and H. Schramek. Characterization of an ochratoxin-A-dedifferentiated and cloned renal epithelial cell line. Toxicol. Appl. Pharmacol. 152, 282-291, 1998 [abstract]
Sauvant, C., S. Silbernagl and M. Gekle. Exposure of renal proximal-tubule derived cells to naturally occurring concentrations of ochratoxin A preferentially impairs the organic anion transporter OAT1. Proceedings 20th Mycotoxin-Workshop, Detmold 64-68, 1998
Gekle, M., C. Martinez, S. Mildenberger, R. Freudinger, G. Schwerdt, C. Sauvant and S. Silbernagl. Susceptibility of human kidney cells to the ubiquitous food contaminant ochratoxin A. Proceedings 20th Mycotoxin-Workshop, Detmold 76-80, 1998
Schwerdt, G., R. Freudinger, S. Silbernagl and M. Gekle. Detection of ochratoxin-A-binding proteins in different rat organs and renal cell lines. Proceedings 20th Mycotoxin-Workshop, Detmold 257-261, 1998
Sauvant, C., S. Silbernagl and M. Gekle. Exposure to ochratoxin A impairs organic anion transport in proximal-tubule-derived Opossum kidney cells. J. Pharmacol. Exp. Ther. 287, 13-20, 1998 [abstract]
Schwerdt, G., R. Freudinger, S. Silbernagl and M. Gekle. Apical uptake of radiolabelled ochratoxin A into Madin-Darby canine kidney cells. Toxicology 131, 193-202, 1998 [abstract]
1997
Zingerle, M., S. Silbernagl and M. Gekle. Reabsorption of the nephrotoxin ochratoxin A along the rat nephron in vivo. J. Pharmacol. Exp. Ther. 280, 220-224, 1997 [abstract]
Schwerdt, G., M. Gekle, R. Freudinger, S. Mildenberger and S. Silbernagl. Apical-to-basolateral transepithelial transport of ochratoxin A by two subtypes of Madin-Darby canine kidney cells. Biochem. Biophys. Acta 1324, 191-199, 1997 [abstract]
Bahnemann, E., H.P. Kerling, S. Ensminger, G. Schwerdt, S. Silbernagl and M. Gekle. Renal transepithelial secretion of ochratoxin A in the non-filtering toad kidney. Toxicology 120, 11-17, 1997 [abstract]
Kuramochi, G., M. Gekle and S. Silbernagl. Ochratoxin A disturbs pH homeostasis in the kidney: increases in pH and HCO3- in the tubules and vasa recta. Pflügers Arch. 434, 392-397, 1997 [abstract]
Sauvant, C., S. Silbernagl and M. Gekle. Effect of chronic exposure to ochratoxin A on organic anion transport systems in OK cells. Proceedings 19th Int. Mycotoxin-Workshop, München 100-104, 1997
Schwerdt, G., M. Zingerle, R. Freudinger, M. Gekle and S. Silbernagl. Reabsorptive uptake of ochratoxin A in rat kidney collecting duct and in MDCK-cells. Proceedings 19th Int. Mycotoxin-Workshop, München 95-99, 1997
Gekle, M., S. Wünsch, G. Kuramochi, R. Freudinger, S. Mildenberger, S. Silbernagl. The renal collecting duct as a target of acute ochratoxin A exposure: Effects on acid-base homeostasis. Proceedings 19th Int. Mycotoxin-Workshop, München 90-94, 1997
Schramek, H., D. Wilfingseder, V. Pollack, R. Freudinger, S. Mildenberger and M. Gekle. Ochratoxin A-induced stimulation of extracellular signal-regulated kinases 1/2 is associated with Madin-Darby canine kidney-C7 cell dedifferentition. J. Pharmacol. Exp. Ther. 283, 1460-1468, 1997 [abstract]
1996
Schwerdt, G., K. Bauer, M. Gekle and S. Silbernagl. Accumulation of ochratoxin A in rat kidney in vivo and in cultivated renal epithelial cells in vitro. Toxicology 114, 177-185, 1996 [abstract]
Gekle, M. and S. Silbernagl. Renal toxicodynamics of ochratoxin A: A pathophysiological approach. Kidney Blood Press. Res. 19, 225-235, 1996. [abstract]
1995
Gekle, M., Pollock, C.A., and S. Silbernagl. Time- and concentration-dependent biphasic effect of ochratoxin A on growth of proximal tubular cells in primary culture. J.Pharmacol.Exp.Ther. 275, 397-404, 1995. [abstract]
1994
Bauer, K., M. Gekle, and S. Silbernagl. Untersuchungen zur Verteilung von Ochratoxin A in unterschiedlichen Nierenabschnitten. (Distribution of ochratoxin A in different kidney sections) Proceedings 16th Int. Mycotoxin-Workshop, Hohenheim 139-142, 1994.
Gekle, M. and S. Silbernagl. The role of the proximal tubule in ochratoxin A nephrotoxicity in vivo: toxodynamic and toxokinetic aspects. Renal Physiol Biochem 17:40-49, 1994. [abstract]
Gekle, M., R. Vogt, H. Oberleithner, and S. Silbernagl. The mycotoxin ochratoxin A deranges pH homeostasis in Madin-Darby canine kidney cells. J. Membrane Biol. 139: 183-190, 1994. [abstract]
Gekle, M., Mildenberger, S., Freudinger, R., and S. Silbernagl. The mycotoxin ochratoxin A impairs protein uptake in cells derived from the proximal tubule of the kidney (opossum kidney cells). J.Pharmacol.Exp.Ther. 271:1-6, 1994. [abstract]
Gekle, M., S. Wünsch, H. Oberleithner, and S. Silbernagl. Characterization of two MDCK-cell subtypes as a model system to study principal and intercalated cell properties. Pflügers Arch. 428: 157-162, 1994. [abstract]
1993
Gekle, M., H. Oberleithner and S. Silbernagl. Ochratoxin A impairs postproximal nephron function in vivo and blocks plasma membrane anion conductance in Madin-Darby canine kidney cells in vitro. Pflügers Arch. 425: 401-408, 1993. [abstract]
Gekle, M. and S. Silbernagl. Mechanism of ochratoxin A-induced reduction of glomerular filtration rate. J. Pharmacol. Exp. Ther. 276: 316-321, 1993. [abstract]
Gekle, M., S. Silbernagl, S. Mildenberger and R. Freudinger. Effect on dome formation and uptake of Ochratoxin A in proximal tubule-derived Opossum kidney cell monolayers. Cell Physiol Biochem 3: 68-77, 1993.
Kardiologisch-intensivmedizinisch relevante Erkrankungen, wie infarktbedingter kardiogener Schock, Sepsis, Multiorganversagen oder Herzinsuffizienz sind durch systemische Inflammationsprozesse charakterisiert. Wie im Vorantrag (SCHM 1398/2-1,-2) gezeigt werden konnte, ist diese systemische Entzündungsreaktion eng mit der Entwicklung einer prognostisch ungünstigen Reduktion der Herzfrequenzvariabilität (HRV) bei gleichzeitig inadäquatem Herzfrequenzanstieg assoziiert. Die hierfür verantwortlichen Mechanismen sind bisher jedoch nicht genau bekannt. Wir konnten unlängst allerdings zeigen, dass bakterielles Endotoxin konzentrationsabhängig den Schrittmacherstrom If im menschlichen Vorhofgewebe hemmt und somit einen kausalen Erklärungsansatz für die genannten Phänomene darstellen könnte.
Mit dem jetzt beantragten Forschungsprojekt soll zum einen der Mechanismus der Endotoxin-induzierten Hemmung des kardialen Schrittmacherstroms If, dessen HCN-Isoform-Spezifität und der resultierende Einfluss auf Herzfrequenz und HRV analysiert werden. Darauf aufbauend kann dann untersucht werden, inwiefern sich im Rahmen des infarktbedingten kardiogenen Schocks und im Sepsismodell das kardiale Expressionsmuster der HCN-Isoformen ändert, und ob dies möglicherweise zu den genannten negativen Effekten im Herzen beiträgt.
Damit können wesentliche Beiträge zur Aufklärung der Mechanismen der prognostisch bedeutsamen autonomen Dysfunktion geleistet und neue therapeutische Ansatzpunkte zur Modulation dieses Phänomens aufgezeigt werden.
Related articles:
2011
Klöckner U, Rueckschloss U, Grossmann C, Ebelt H, Müller-Werdan U, Loppnow H, Werdan K, Gekle M. Differential reduction of HCN channel activity by various types of lipopolysaccharide. J Mol Cell Cardiol. ;51(2):226-235. 2011. [abstract]
Transportphysiologie und –pathophysiologie
Viele wichtige Medikamente (z.B. Antibiotika, Zytostatika, Zyklooxygenasehemmer) und endogene Substrate wie Prostaglandine, Urat und Oxalat sind organische Anionen. Das renale Sekretionsssystem für organische Anionen ist im proximalen Tubulus lokalisiert. Der geschwindigkeitsbestimmende Schritt ist die basolaterale Aufnahme organischer Anionen. Die Aktivität dieses renalen Sekretionssystems entscheidet über Konzentration und Verweildauer organischer Anionen im Organismus, sie ist also mitentscheidend für Wirkung oder Toxizität dieser Substanzen. Bisher sind noch keine konkreten Signalwege bekannt, die den renalen organischen Anionentransport auf Expressionsebene regulieren.
Durch Studien an Ratten konnten wir zeigen, (i) dass nach renaler Ischämie die Sekretion organischer Anionen reversibel gehemmt ist. (ii) Das gilt auch für die Expression der Proteine, welche den geschwindigkeitsbestimmenden, basolateralen Schritt der Sekretion vermitteln. (iii) Diese Ergebnisse konnten wir an einem in vitro-Ischämie-Modell an proximalen Tubuluszellen der Ratte reproduzieren. (iiii) Studien am Ischämie-Modell mit Zyklooxygenasehemmern und Prostaglandin E2 legen eine Beteiligung von Prostaglandin E2 an der durch Ischämie induzierten Expressionshemmung nahe.
Daraus ergibt sich eine attraktive Hypothese zum Mechanismus der durch Ischämie induzierten Hemmung der renalen Sekretion organischer Anionen: Ischämie induziert die Bildung von Prostaglandin E2, welches zur Expressionshemmung der basolateralen Transportproteine für organische Anionen führt. In unserem Projekt sollen die Mechanismen der durch Ischämie induzierten Expressionshemmung der basolateralen Transportproteine für organische Anionen untersucht werden. Dabei sollen erstmals konkrete Signalwege beschrieben werden, die die renale Sekretion organischer Anionen regulieren.
Einfluss des metabolischen Mikromilieus solider Tumoren auf die Aktivität von Medikamententransportern: Bedeutung für die Chemosensibilität von Tumoren in vivo.
Sowohl experimentelle als auch humane Tumoren zeigen im Vergleich zu Normalgeweben ein deutlich verändertes metabolisches Mikromilieu. So lässt sich in über 50% der klinischen Tumoren ein ausgeprägter O2-Mangel (Hypoxie) nachweisen. Um trotzdem eine ausreichende Energieversorgung sicher zu stellen, forciert die Tumorzelle den anaeroben Stoffwechselweg, wobei Glukose direkt zu Milchsäure umgesetzt wird, sodass sich in vielen Tumoren ein ausgeprägter Glukosemangel, eine Laktatzunahme sowie eine starke extrazelluläre Azidose (pH<6,8) nachweisen lässt. Auf der anderen Seite ist seit längerer Zeit bekannt, dass die Tumorhypoxie die Wirksamkeit verschiedener Chemotherapeutika einschränkt. So benötigen einige Pharmaka molekularen Sauerstoff, um ihre zytotoxische Wirksamkeit zu entfalten (z.B. Alkylatien). Jedoch müssen auch indirekte Effekte des O2-Mangels berücksichtigt werden, wie beispielsweise eine Beeinflussung der Pharmakokinetik durch die extrazelluläre Azidose.
Auf der anderen Seite verfügen viele Tumorzellen über aktive Transportmechanismen, die Pharmaka unter direktem ATP-Verbrauch aus der Zelle transportieren können (ABC-Transporter), deren wichtigste Vertreter das p-Glykoprotein (pGP, Produkt des MDR1-Gens) sowie das Multidrug-resistance associated protein 1 (MRP1) sind. Da zahlreiche solide wachsende Tumoren diese Transporter exprimieren, werden sie für ein vermindertes Ansprechen dieser Malignome gegenüber verschiedenen Chemotherapeutika verantwortlich gemacht. Andererseits könnte die Hemmung dieser Medikamententransporter zu einer Steigerung der zytotoxischen Wirksamkeit verschiedener Chemotherapeutika führen. Die Aktivität dieser ABC-Transporter kann durch verschiedene Zytokine, Onkogene oder Tumorsupressorgene beeinflusst werden, wobei sowohl die Expression der Transporter als auch deren funktionelle Transportleistung einer Modulation zu unterliegen scheinen. Über eine Beeinflussung der Transporter-Aktivität durch das metabolische Mikromilieu (Hypoxie, Azidose, Hypoglykämie) ist bisher nur sehr wenig bekannt. Eigene Vorarbeiten deuten jedoch darauf hin, dass metabolische Veränderungen im Tumor zu einer Steigerung der Pumpenaktivität und somit zu einer erhöhten Resistenz gegenüber verschiedenen Chemotherapeutika führen. Die zugrunde liegenden Mechanismen sind bisher jedoch nicht bekannt.
Related articles:
Hypoxia-induced extracellular acidosis increases p-glycoprotein activity and chemoresistance in tumors in vivo via p38 signaling pathway.
Thews O, Nowak M, Sauvant C, Gekle M.
Adv Exp Med Biol. 2011;701:115-22. [abstract]
Acidic Environment Leads to ROS-Induced MAPK Signaling in Cancer Cells.
Riemann A, Schneider B, Ihling A, Nowak M, Sauvant C, Thews O, Gekle M.
PLoS One. 2011;6(7):e22445. Epub 2011 Jul 26. [abstract]
SCHNEIDER R, MEUSEL M, RENKER S, BAUER C, HOLZINGER H, ROEDER M, WANNER C, GEKLE M, SAUVANT C.
Low-dose indomethacin after ischemic acute kidney injury prevents downregulation of Oat1/3 and improves renal outcome.
Am J Physiol Renal Physiol. 2009 Dec;297(6):F1614-21. Epub 2009 Sep 30. [abstract]
SAUVANT C, SCHNEIDER R, HOLZINGER H, RENKER S, WANNER C, GEKLE M.
Indomethacin corrects alterations associated with ischemia/reperfusion in an in vitro proximal tubular model.
Am J Nephrol. 2010;32(1):57-65. Epub 2010 Jun 7. [abstract]
SAUVANT C, SCHNEIDER R, HOLZINGER H, RENKER S, WANNER C, GEKLE M.:
Implementation of an in vitro model system for investigation of reperfusion damage after renal ischemia.
Cell Physiol Biochem. 2009;24(5-6):567-76. Epub 2009 Nov 4 [abstract]
SAUVANT, C., NOWAK, M., WIRTH, C., SCHNEIDER, B., RIEMANN, A., GEKLE, M. AND THEWS, O.: Acidosis induces multi-drug resistance in rat prostate cancer cells (AT1) in vitro and in vivo by increasing the activity of the p-glycoprotein via activation of p38. Int. J. Cancer 123(11), 2532-2543, 2008 [abstract]
SAUVANT, C, THEWS, O., WIRTH, C. AND GEKLE, M.: Direct determination of intracellular daunorubicin in intact confluent monolayers of AT1 prostate carcinoma cells using a multiwell-multilabel counter. Anal. Biochem. 381(1), 81-85, 2008 [abstract]
THEWS, O., GASSNER, B., KELLEHER, DK. AND GEKLE, M.: Activity of drug efflux transporters in tumor cells under hypoxic conditions. Adv. Exp. Med. Biol. 614, 157-164, 2008 [abstract]
THEWS, O., GASSNER, B. KELLEHER, DK., SCHWERDT, G. AND GEKLE, M.: Impact of hypoxic and acidic extracellular conditions on cytotoxicity of chemotherapeutic drugs. Adv. Exp. Med. Biol. 599, 155,161, 2007 [abstract]
SCHNEIDER, R., SAUVANT, C., BETZ, B., OTREMBA, M., FISCHER, D., HOLZINGER, H., WANNER, C., GALLE, J. AND GEKLE, M.: Down regulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of papa-aminohippurate after ischemic acute renal failure in rats. Am. J. Physiol. Renal Physiol. 2007 [abstract]
LOTZ, C., KELLEHER, DK., GASSNER, B., GEKLE, M., VAUPEL, P. AND THEWS, O.: Role of tumor microenvironment in the activity and expression of the p-glykoprotein in human colon carcinoma cells. Oncol. Rep. 17 (1), 239-244, 2007 [abstract]
THEWS, O., GASSNER, B., KELLEHER, D.K., SCHWERDT, G. AND GEKLE, M.: Impact of extracellular acitity on the activity of p-glycoprotein and the cytotoxicity of chemotherapeutic drugs. Neoplasia 8, 143-152, 2006 [abstract]
SAUVANT, C. HOLZINGER, H. AND GEKLE, M.: Prostaglandin E2 inhibits its own renal transport by downregulation of organic anion transporters rOAT1 and rOAT3. J. Am. Soc. Nephrol. 17, 46-53, 2006 [abstract]
HESSE, D., SAUVANT, C., HOLZINGER, H. AND GEKLE, M.: Apical expression or expression in a non-polarized cell of hOAT1 inverses regulation by epidermal growth factor (EGF) as compared to basolateral hOAT1. Cell Physiol. Biochem. 14, 177 - 186, 2004 [abstract]
SAUVANT, C., HESSE, D., HOLZINGER, H., EVANS, K.K., DANTZLER, W.H. AND GEKLE, M.: Action of EGF and PGE2 on basolateral organic anion uptake in rabbit proximal renal tubules and hOAT1 expressed in human kidney epithelial cells. Am. J. Physiol. Renal Physiol. 286, F774-F783, 2004 [abstract]
SAUVANT, C., HOLZINGER, H. AND GEKLE, M.: Short-term regulation of basolateral organic anion uptake in proximal tubular opossum kidney cells: Prostaglandin E(2) acts via receptor-mediated activation of protein kinase A. J. Am. Soc. Nephrol. 14, 3017-3026, 2003 [abstract]
SAUVANT, C., HOLZINGER, H. AND GEKLE, M.: Short-term regulation of basolateral organic anion uptake in proximal tubular OK cells: EGF acts via MAPK, PLA(2), and COX1. J. Am. Soc. Nephrol. 13, 1981-1991, 2002 [abstract]
ISLINGER, F., GEKLE, M. AND WRIGHT, S.: Interaction of 2,3-dimercapto-1-propane sulfonate with the human organic anion transporter hOAT1. J. Pharmacol. Exp. Ther. 299, 741-747, 2001 [abstract]
SAUVANT, C., HOLZINGER, H. AND GEKLE, M.: Modulation of the basolateral and apical step of transepithelial organic anion secretion in proximal tubular OK cells: Acute Effects of EGF and MAPK. J. Biol. Chem. 276 (18) 14695-14703, 2001 [abstract]
SAUVANT, C. AND GEKLE, M.: Effect of EGF, MAPK and PLA2 on initial basolateral organic anion transport in OK-cells. Pflügers Arch. 439 supplement (6): R348, 2000 (Abstract)
SAUVANT, C., SILBERNAGL, S. AND GEKLE, M.: Effect of EGF, PKC and MAPK on secretory organic anion transport in OK-cells. Kidney Blood Press.Res 22: 199-199, 1999.(Abstract)
GEKLE, M., MILDENBERGER, S., SAUVANT, C., BEDNARCZYK, D., WRIGHT, S.H. AND DANTZLER, W.H.: Inhibition of the initial transport rate of the basolateral organic anion carrier in renal proximal tubules by bradykinin and phenylephrine. Am J Physiol 277: F251-F256, 1999. [abstract]
GEKLE, M., MILDENBERGER, S., SAUVANT, C., BEDNARCZYK, D., WRIGHT, S.H. AND DANTZLER, W.H.: Activation of protein kinase C inhibits the initial transport rate of the basolateral organic anion carrier in single rabbit renal proximal tubules. FASEB J 13: A61, 1999. (Abstract)
Physiologie und Pathophysiologie der Proteinendozytose in renalen proximalen Tubuluszellen
In der Niere werden Proteine des Blutplasmas unter physiologischen Bedingungen nur eingeschränkt glomerulär filtriert. Diese filtrierten Proteine werden anschließend im proximalen Tubulus des Nephrons durch Rezeptor-vermittelte Endozytose resorbiert. Durch diese Resorption wird zum einen der Verlust von Aminosäuren, zum anderen jedoch auch der Verlust von anderen wertvollen Substanzen, wie Vitamine, verhindert. Außerdem ist diese Endozytose dafür verantwortlich, dass (i) die Vitamin-D-Vorstufe zur endgültigen Aktivierung in die proximalen Tubuluszellen gelangt und (ii), dass die Oberflächenexpression von Membranproteinen adäquat reguliert wird. Der größte Teil der Endozytose wird durch den Rezeptorkomplex Megalin/Cubilin vermittelt. Der geschilderten Endozytose kommt eine dreifache pathophysiologische Bedeutung zu: Verminderte Endozytose führt zum Verlust von Aminosäuren und Vitaminen; bei vermehrtem Proteinangebot führt die vermehrte Proteinendozytose zu pathologischen - sowohl fibrotischen als auch entzündlichen - Veränderungen des Nierengewebes; veränderte Endozytoseraten können zu pathologisch veränderter Oberflächenexpression von Membranproteinen führen. Das Ziel unseres Projektes ist es, (a) die Mechanismen der physiologischen und pathophysiologischen Regulation der Endozytose besser zu verstehen und (b) die zellulären Vorgänge im Rahmen der proteininduzierten Veränderungen sowie deren Modulierbarkeit genauer zu charakterisieren. Die erhobenen Befunde sollen auch langfristig dazu beitragen Therapiekonzepte im Rahmen von interstitiellen Nierenerkrankungen zu entwickeln.
Entwicklung von Therapiestrategien zur Verhinderung proteinurieinduzierter interstitieller Nierenschäden
Fortschreitende interstitielle Fibrose (bindegewebiger Umbau) der Niere ist bei vielen Erkrankungen für die Entwicklung eines chronischen Nierenversagens (ca. 10.000 Neuerkranungen/Jahr in Deutschland) entscheidend. Dieses führt zu lebensbedrohlichen Veränderungen des Salz-, Wasser-, Vitamin- und Hormonhaushaltes sowie der Entgiftungsfunktion, wodurch eine Nierenersatztherapie (Dialyse, Transplantation) notwendig wird. Das Fortschreiten der Fibrose wird ganz wesentlich durch die Wechselwirkung bestimmter Zellen der Nierenkanälchen (proximale Tubuli) mit filtrierten Proteinen bestimmt. Diese Zellen üben bei vermehrter Proteinfiltration eine profibrotische und proinflammatorische Wirkung aus. Die Rolle der Proteinaufnahme in diese proximalen Tubuluszellen sowie der anschließend ablaufenden Signalvorgänge für die Entwicklung der Fibrose ist größtenteils noch nicht bekannt. Ziel unseres Vorhabens ist die genaue Charakterisierung der Bedeutung von Proteinaufnahme und der verantwortlichen Signalvorgänge im Rahmen der Fibroseentwicklung und das Austesten daraus abgeleiteter Therapiestrategien. Unsere Ergebnisse sollen zur Entwicklung von Therapiekonzepten bei interstitiellen Nierenerkrankungen beitragen.
Related articles:
Gekle, M. Renal albumin handling: A look at the dark side of the filter. Kidney Int. 71, 479-481, 2007 [abstract]
Gekle, M. Renal tubule albumin transport. Annu. Rev. Physiol. 67, 573-594, 2005 [abstract]
Gekle, M., K. Völker, S. Mildenberger, R. Freudinger, G.E. Shull and M. Wiemann. NHE3 Na+/H+ exchanger supports proximal tubular protein reabsorption in vivo. Am. J. Physiol. Renal Physiol. 287, F469 - F473, 2004 [abstract]
Gekle, M., P.Knaus, R. Nielsen, S. Mildenberger, R. Freudinger, V. Wohlfahrt, C. Sauvant and E.I. Christensen. Transforming growth factor-beta1 reduces megallin- and cubilin-mediated endocytosis of albumin in proximal-tubule-derived opossum kidney cells. J. Physiol. 552, 471-481, 2003 [abstract]
Drumm, K., E. Lee, S. Stanners, B. Gassner, M. Gekle, P. Poronnik and C.A. Pollock. Albumin and glucose effects on cell growth parameters, albumin uptake and Na+/H+-exchanger isoform 3 in OK cells. Cell Physiol. Biochem. 13, 199-206, 2003 [abstract]
Wohlfarth, V., K. Drumm, S. Mildenberger, R. Freudinger and M. Gekle. Protein uptake disturbs collagen homeostasis in proximal tubule-derived cells. Kidney Int. Suppl. 103-109, 2003 [abstract]
Drumm, K., B. Bauer, R. Freudinger and M. Gekle. Albumin induces NF-kappaB expression in human proximal tubule-derived cells (IHKE-1). Cell Physiol. Biochem. 12, 187-196, 2002 [abstract]
Gekle, M., O.K. Serrano, K. Drumm, S. Mildenberger, R. Freudinger, B. Gaßner, H.W. Jansen and E.I. Christensen. NHE3 serves as a molecular tool for cAMP-mediated regulation of receptor-mediated endocytosis. Am. J. Physiol. Renal Physiol. 283, F549-F558, 2002 [abstract]
Drumm, K., B. Gassner, S. Silbernagl and M. Gekle. Inhibition of Na+/H+ exchange decreases albumin-induced NF-kappaB activation in renal proximal tubular cell lines (OK and LLC-PK1 cells). Eur. J. Med. Res. 6, 422-432, 2001 [abstract]
Gekle, M., R. Freudinger, S. Mildenberger and C. Sauvant. Determination of basolateral Na+/H+ exchange activity in MDCK cells using a multiwell-multilabel reader. Anal. Biochem. 296, 174-178, 2001 [abstract]
Drumm, K., B. Gassner, S. Silbernagl and M. Gekle. Albumin in the mg/l-range activates NF-kappaB in renal proximal tubule-derived cell lines via tyrosine kinase and protein kinase C. Eur. J. Med. Res. 6, 247-258, 2001 [abstract]
Drumm, K., B. Gassner, S. Silbernagl and M. Gekle. Inhibition of Na+/H+ exchange suppresses albumin-induced NF-kB activation in proximal tubular cells of the kidney. Nieren und Hochdruckkrankheiten 30 (4), 141-1449, 2001
Gekle, M., R. Freudinger and S. Mildenberger. Inhibition of Na+-H+ exchanger 3 interferes with apical receptor-mediated endocytosis via vesicle fusion. J. Physiol. 531, 619-629, 2001 [abstract]
Zhai, X.Y., R. Nielsen, H. Birn, K. Drumm, S. Mildenberger, R. Freudinger, S.K. Moestrup, P.J. Verroust, E.I. Christensen and M. Gekle. Cubilin- and megalin-mediated uptake of albumin in cultured proximal tubule cells of opossum kidney. Kidney Int. 58, 1523-1533, 2000 [abstract]
Gekle, M., K. Drumm, S. Mildenberger, R. Freudinger, B. Gaßner and S. Silbernagl. Inhibition of Na+-H+ exchange impairs receptor-mediated albumin endocytosis in renal proximal tubule-derived epithelial cells from opossum. J. Physiol. 520, 709-721, 1999 [abstract]
Gekle, M., S. Mildenberger, R. Freudinger and S. Silbernagl. Long-term exposure reduces albumin binding and uptake in proximal tubule-derived opossum kidney cells. J. Am. Soc. Nephrol. 9, 960-968 1998 [abstract]
Gekle, M. Renal proximal tubule albumin reabsorption: daily prevention of albuminuria. News Physiol. Sci. 13, 5-11, 1998 [abstract]
Gekle, M., S. Mildenberger, R. Freudinger, G. Schwerdt and S. Silbernagl. Albumin endocytosis in OK cells: dependence on actin and microtubules and regulation by protein kinases. Am. J. Physiol. 272:1 F668-F677, 1997 [abstract]
Gekle, M., S. Mildenberger, R. Freudinger and S. Silbernagl. Functional characterization of albumin binding to the apical membrane of OK cells. Am. J. Physiol. 271: F286-F291, 1996 [abstract]
Gekle, M., S. Mildenberger, R. Freudinger, and S. Silbernagl. Kinetics of receptor-mediated endocytosis of albumin in cells derived from the proximal tubule of the kidney (Opossum kidney cells): Influence of Ca2+ and cAMP. Pflügers Arch. 430: 374-380, 1995. [abstract]
Gekle, M., S. Mildenberger, R. Freudinger, and S. Silbernagl. Endosomal alkalinization reduces Jmax and Km of albumin receptor-mediated endocytosis in OK cells. Am. J. Physiol. 268: F899-F906, 1995. [abstract]
Gekle, M., S. Mildenberger, R. Freudinger, and S. Silbernagl. The mycotoxin ochratoxin A impairs protein uptake in cells derived from the proximal tubule of the kidney (opossum kidney cells). J. Pharmacol. Exp. Ther. 271: 1-6, 1994. [abstract]
Chronic interstitial deregulation of tissue homeostasis (parainflammation) is a risk factor for fibrosis and carcinogenesis. The mechanisms of unbalanced tissue homeostasis involve altered transcriptional and post-transcriptional regulatory mechanisms, including non-coding RNAs such as microRNAs (miR) or long non-coding RNAs (lncRNAs). LncRNAs belong to a rapidly growing class of RNAs and are defined as non-coding transcripts longer than 200 nucleotides. They are involved in processes like chromatin modification, transcriptional and post-transcriptional gene regulation. For example, lncRNAs have been shown to sequester miRNAs and thereby promote the expression of miRNA-target genes (sponge-like action). Wnt1-inducible signaling pathway protein 1 (WISP1) is involved in organ development but also in fibrogenic and cancerous tissue alterations. It belongs to the CCN family of connective tissue growth factors and is canonically regulated by the Wnt1/β-catenin pathway. Also, some splice variants and other alternative transcripts expressed from the WISP1 locus with mostly unknown function have been described. Some of these appear to act as non-coding RNAs. Our recent data showed that an alternative WISP1 transcript is upregulated by different cell stressors in renal cells leading to the increased formation of extracellular matrix (ECM) components such as collagens. This suggests a role of the WISP1 locus in pathological cellular processes, in particular fibrosis. Accordingly, the identification and characterization of triggers and mechanisms involved in WISP1 RNA-induced deregulation of tissue homeostasis may contribute to the understanding of organ and tissue remodeling and malfunction. These studies have to address: 1) relevant cell stressors; 2) signaling pathways involved in non-coding RNA expression; 3) interactions of non-coding RNAs and their crosstalk with target gene expression.