Forschungsgebiete
Erkrankungen des Herzkreislaufsystems zählen zu den „Volkskrankheiten“ und häufigsten Todesursachen. Aktuelle Untersuchungen belegen, dass hierbei die übermäßige Aktivierung des Renin-Angiotensin-Aldosteron-System (RAAS) einen wichtigen Risikofaktor darstellt. Das RAAS besteht aus einer Hormon-Enzym-Kaskade, an deren Ende die Freisetzung von Aldosteron aus der Nebenniere steht.
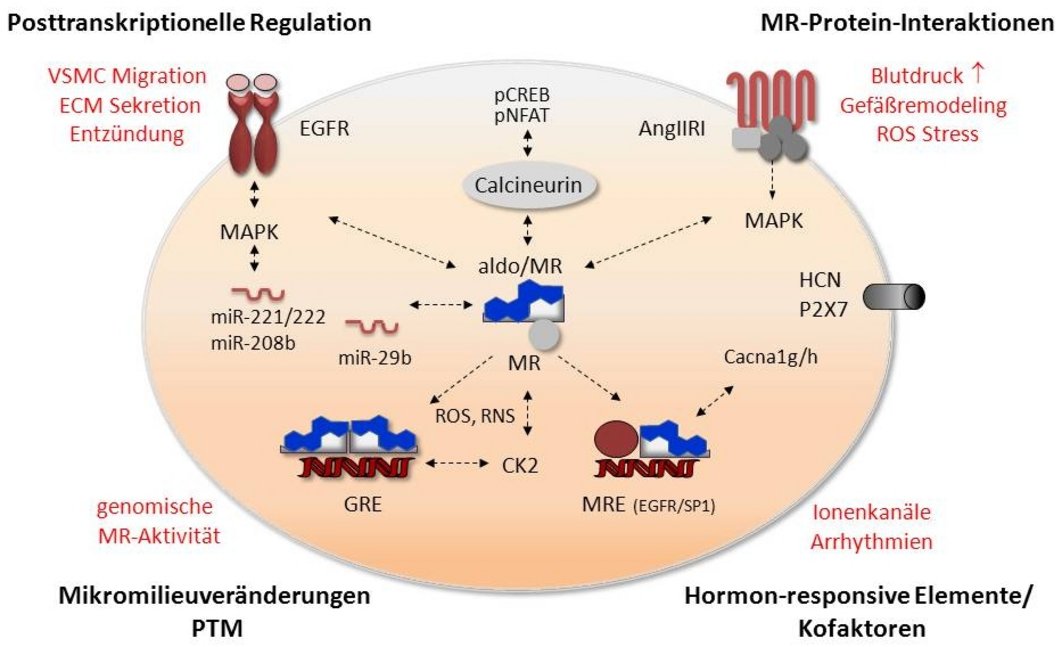
Aldosteron ist ein Kortikosteroidhormon und bindet an den Mineralokortikoidrezeptor (MR), der in vielen verschiedenen Geweben vorkommt und nach Bindung seines Liganden als Transkriptionsfaktor im Zellkern wirkt. Unter physiologischen Bedingungen ist der MR für die Regulation des Wasser-Elektrolyt-Haushaltes und damit für die langfristige Blutdruckkontrolle zuständig. Gleichzeitig kann er durch noch nicht vollständig verstandene Mechanismen zu Umbauprozessen im Herzkreislaufsystem mit Begünstigung von Fibrose, Hypertrophie und entzündlichen Vorgängen führen. Gegenstand unserer Forschung sind molekulare Mechanismen, die diesen pathologischen Veränderungen zugrundeliegen.
Der MR gehört zur Familie der Steroidrezeptoren und befindet sich im unstimulierten Zustand an HSP90 und andere Chaperone gebunden im Zytosol. Nach Ligandenbindung transloziert er in den Zellkern, bindet als Homodimer an Hormon-responsive Elemente und wirkt dann als Transkriptionsfaktor. In diesem Projekt werden die molekularen Mechanismen des nukleären Shuttlings, der Dimerisierung und der spezifischen DNA-Bindung näher untersucht, insbesondere die Bedeutung von HSP90.
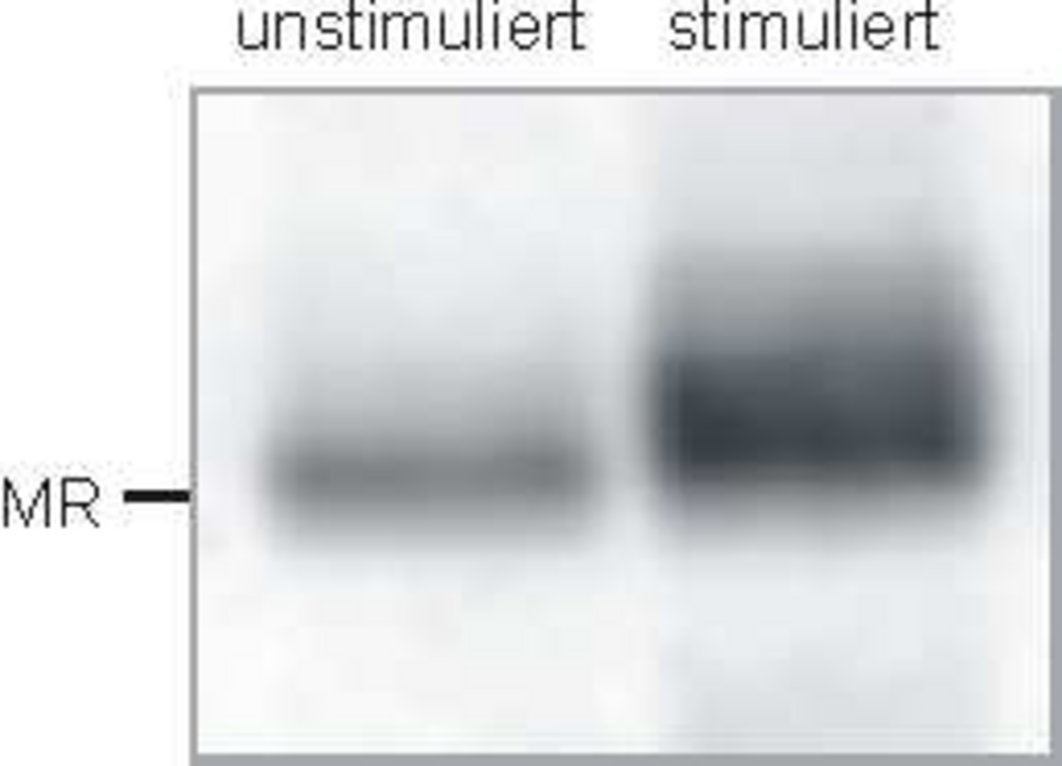
Untersuchungen haben ergeben, dass hohe Aldosteronkonzentrationen alleine nicht zu pathologischen Gewebsveränderungen durch den MR führen; stattdessen bedarf es zusätzlicher Stressoren wie Radikalstress, NaCl oder Entzündungsmediatoren. Ein möglicher Mechanismus für den Wandel von physiologischen zu pathologischen MR-Wirkungen könnten posttranslationale Modifikationen des MR sein, die durch das Mikromilieu hervorgerufen werden. Daher untersuchen wir den Einfluss von nitrosativem Stress und von Stress-induzierten Kinasen auf den Zustand und die Wirkung des MR.
Als DNA-Bindungselement des MR wurde bisher nur das Glukokortikoid-responsive Element (GRE) beschrieben, das gemeinsam von MR und seinem nächsten Verwandten, dem Glukokortikoidrezeptor, genutzt wird, der jedoch unterschiedliche Effekte vermittelt. Wir suchen mit verschiedenen Versuchsansätzen nach weiteren, MR-spezifischen DNA-Bindemotiven und MR-spezifischen Genen, um sie anschließend zu charakterisieren. Speziell ein Promotorbereich des epidermalen Wachstumsfaktorrezeptors findet hierbei Berücksichtigung mit SP1 als Kofaktor.
Der MR kann nicht nur als ligandengebundener Transkriptionsfaktor die Expression von Zielgenen beeinflussen, sondern er kann auch mit anderen Signalwegen in unterschiedlichen zellulären Kompartimenten reagieren. Fokus unserer Untersuchungen im Herzkreislaufsystem sind die Interaktionen mit dem Signalweg des epidermalen Wachstumsfaktorrezeptors (EGFR), der Serin-Threonin-Phosphatase Calcineurin und mit anderen Bestandteilen des Renin-Angiotensin-Aldosteron-Systems, besonders dem Angiotensin II und seinen Rezeptoren.
Die Expression von Genen lässt sich auch durch posttranskriptionelle Regulation durch kleine nicht-kodierende RNAs (=microRNAs ) beeinflussen.
MicroRNAs sind 17-22 nt lange RNAs, die an das 3‘-Ende von mRNAs binden und dadurch die Translation hemmen oder sogar den Abbau der mRNA induzieren.
Wir beschäftigen uns zum einen mit microRNAs, die durch Kortikosteroidrezeptoren reguliert werden und zum anderen interessieren wir uns für die differenziell exprimierten microRNAs in einem EGFR-KO-Modell mit massiver Herzhypertrophie.
http://www.medizin.uni-halle.de/index.php?id=869&L=1%27%2520and
Publikationen der letzten Jahre
- Ebelt H, Geißler I, Ruccius S, Otto V, Hoffmann S, Korth H, Klöckner U, Zhang Y, Li Y, Grossmann C, Rueckschloss U, Gekle M, Stieber J, Frantz S, Werdan K, Müller-Werdan U, Loppnow H. Direct inhibition, but indirect sensitization of pacemaker activity to sympathetic tone by the interaction of endotoxin with HCN-channels. Clin Exp Pharmacol Physiol. 2015 Apr 30 [Epub ahead of print]. [PubMed]
- Schreier B, Rabe S, Winter S, Ruhs S, Mildenberger S, Schneider B, Sibilia M, Gotthardt M, Kempe S, Mäder K, Grossmann C, Gekle M. Moderate inappropriately high aldosterone/NaCl constellation in mice: cardiovascular effects and the role of cardiovascular epidermal growth factor receptor. Sci Rep. 2014 Dec 11;4:7430. [PubMed]
- Meinel S, Gekle M, Grossmann C. Mineralocorticoid receptor signaling: Crosstalk with membrane receptors and other modulators. Steroids. 2014 Dec;91C:3-10. [PubMed]
- Korte S, Sträter AS, Drüppel V, Oberleithner H, Jeggle P, Grossmann C, Fobker M, Nofer JR, Brand E, Kusche-Vihrog K. Feedforward activation of endothelial ENaC by high sodium. FASEB J. 2014 Sept;28(9):4015-25. [PubMed]
- Schreier B, Gekle M, Grossmann C. Role of epidermal growth factor receptor in vascular structure and function. Curr Opin Nephrol Hypertens. 2014 Mar;23(2):113-21. [PubMed]
- Klöckner U, Rueckschloss U, Grossmann C, Matzat S, Schumann K, Ebelt H, Müller-Werdan U, Loppnow H, Werdan K, Gekle M. Inhibition of cardiac pacemaker channel hHCN2 depends on intercalation of lipopolysaccharide into channel-containing membrane microdomains. J Physiol. 2014 Mar 15;592(Pt6):1199-211. [PubMed]
- Gekle M, Bretschneider M, Meinel S, Ruhs S, Grossmann C. Rapid mineralocorticoid receptor trafficking. Steroids. 2014 Mar;81:103-8. [PubMed]
- Drüppel V, Kusche-Vihrog K, Grossmann C, Gekle M, Kasprzak B, Brand E, Pavenstädt H, Oberleithner H, Kliche K. Long-term application of the aldosterone antagonist spironolactone prevents stiff endothelial cell syndrome. FASEB J. 2013 Sep;27(9):3652-9. [PubMed]
- Meinel S, Ruhs S, Schumann K, Strätz N, Trenkmann K, Grosse I, Keilwagen J, Gekle M, Grossmann C. Mineralocorticoid Receptor Interaction with SP1 Generates a New Response Element for Gene Expression, Nucleic Acids Research 2013 Sep;41(17):8045-60. [PubMed]
- Schreier B, Rabe S, Schneider B, Bretschneider M, Rupp S, Ruhs S, Neumann J, Rueckschloss U, Sibilia M, Gotthardt M, Grossmann C, Gekle M. Loss of epidermal growth factor receptor in vascular smooth muscle cells and cardiomyocytes causes arterial hypotension and cardiac hypertrophy. Hypertension. 2013 Feb;61(2):333-40. [PubMed]
- Ruhs S, Strätz N, Schlör K, Meinel S, Mildenberger S, Rabe S, Gekle M, Grossmann C. Modulation of transcriptional mineralocorticoid receptor activity by nitrosative stress. Free Radic Biol Med. 2012 Jun 26;53(5):1088-1100. [PubMed]
- Grossmann C, Ruhs, S, Langenbruch, L, Mildenberger, S, Straetz, N, Schumann, K, Gekle, M. Nuclear Shuttling Precedes Dimerization in Mineralocorticoid Receptor Signaling. Chem Biol. 2012 Jun 22;19(6):742-51. [PubMed]
- Grossmann C, Gekle M. Interaction between mineralocorticoid receptor and epidermal growth factor receptor signaling. Mol Cell Endocrinol. 2012 Mar 24;350(2):235-41. [PubMed]
- Schwerdt G, Frisch A, Mildenberger S, Hilgenfeld T, Grossmann C, Gekle M. Influence of Aldosterone and Salt or Ouabain in A10 Rat Aorta Smooth Muscle Cells. J Vasc Res. 2012 Mar 15;49(3):231-241. [PubMed]
- Seiferth A, Ruhs S, Mildenberger S, Gekle M, Grossmann C. The phosphatase calcineurin PP2BAβ mediates part of mineralocorticoid receptor transcriptional activity. FASEB J. 2012 Jun;26(6):2327-37. [PubMed]
- Klöckner U, Rueckschloss U, Grossmann C, Ebelt H, Müller-Werdan U, Loppnow H, Werdan K, Gekle M. Differential reduction of HCN channel activity by various types of lipopolysaccharide. J Mol Cell Cardiol. 2011 Aug;51(2):226-35.
[PubMed]
- Schreier B, Rabe S, Schneider B, Ruhs S, Grossmann C, Hauptmann S, Blessing M, Neumann J, Gekle M. Aldosterone/NaCl-induced renal and cardiac fibrosis is modulated by TGF-β responsiveness of T cells. Hypertens Res. 2011 May;34(5):623-9. [PubMed]
- Schreier B, Döhler M, Rabe S, Schneider B, Schwerdt G, Ruhs S, Sibilia M, Gotthardt M, Gekle M, Grossmann C. Consequences of epidermal growth factor receptor (ErbB1) loss for vascular smooth muscle cells from mice with targeted deletion of ErbB1. Arterioscler Thromb Vasc Biol. 2011 Jul;31(7):1643-52. [PubMed]
- Grossmann C, Ruhs S, Seiferth A, Gekle M. Interaction between mineralocorticoid receptor and cAMP/CREB signaling. Steroids. 2010 Aug-Sep;75(8-9):539-43. [PubMed]
- Günther S, Baba HA, Hauptmann S, Holzhausen HJ, Grossmann C, Punkt K, Kusche T, Jones LR, Gergs U, Neumann J. Losartan reduces mortality in a genetic model of heart failure. Naunyn Schmiedebergs Arch Pharmacol. 2010 Sep;382(3):265-78. [PubMed]
- Grossmann C, Wuttke M, Ruhs S, Seiferth A, Mildenberger S, Rabe S, Schwerdt G, Gekle M. Mineralocorticoid receptor inhibits CREB signaling by calcineurin activation. FASEB J. 2010 Jun;24(6):2010-9. [PubMed]
- Grossmann C, Husse B, Mildenberger S, Schreier B, Schuman K, Gekle M. Colocalization of mineralocorticoid and EGF receptor at the plasma membrane. Biochim Biophys Acta. 2010 May;1803(5):584-90. [PubMed]