Die Entwicklung neuartiger Therapeutika ist ein langwieriges Unterfangen, das langfristig interdisziplinäre Forschungsansätze und Industriepartner erfordert. Akademische Forschung zu den pathophysiologischen und molekularen Mechanismen, die der ncRNA- und RBP-Funktion(en) bei Krebs zugrunde liegen, ist jedoch unerlässlich, um die vorklinische Entwicklung von R3oGE-gerichteten Behandlungskonzepten einzuleiten. Diese Forschung wird Zielkandidaten aufzeigen, die Voraussetzungen für ihre vorklinische Bewertung schaffen und die Begründung für die Erforschung neuartiger therapeutischer Strategien liefern, die in den meisten Fällen aus der akademischen Forschung stammen. An diesen Forschungsschwerpunkten des RU5433 haben Wissenschaftlerinnen und Wissenschaftler des hier vorgeschlagenen Forschungskonsortiums mitgewirkt.
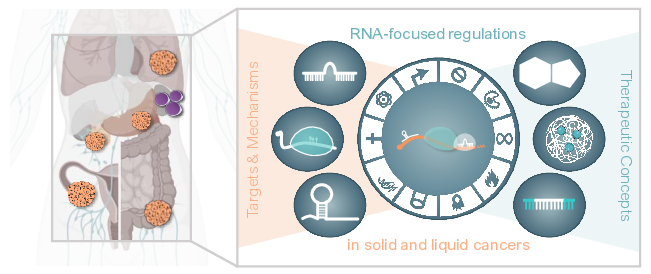
Hallmark-Studien der Labore Heckl/Klusmann identifizierten Krankheiten, die ncRNAs bei Leukämie modulieren – darunter microRNAs (miRNAs; miR) sowie lncRNAs (long non-coding RNAs). Diese zum Teil ERC-finanzierten (Klusmann) Studien bieten einen umfassenden Überblick über die ncRNA-Landschaft der Hämatopoese sowie Leukämie. Dies war entscheidend für die Aufklärung der Rolle, der zugrunde liegenden pathophysiologischen Mechanismen und des therapeutischen Potenzials von miRNAs und lncRNAs bei Leukämie. Ergänzende Forschungen der Labore Aigner, Hämmerle und Hüttelmaier lieferten wesentliche Erkenntnisse über die Rolle und das Zielpotenzial von ncRNAs bei soliden Krebserkrankungen. Die Hüttelmaier-Gruppe entwickelte Techniken und Analyse-Pipelines, um konservierte Funktionen und regulatorische miRNA-mRNA-Netzwerke in Neuroblastomen und Schilddrüsenkarzinomen aufzudecken. Basierend auf der umfassenden Expertise des Labors Aigner zu Nanopartikelformulierungen für die Verabreichung von Nukleinsäuretherapeutika in Krebsmodellen haben gemeinsame Studien mit den Hüttelmaier-Laboren kürzlich die erste In-vivo-Machbarkeitsstudie veröffentlicht, die die Antitumoraktivität von kreisförmigen miR-RNA-Ködern zeigt, die über polymere Nanopartikel abgegeben werden . Das Labor Hämmerle trug zur Charakterisierung von lncRNAs bei Krebs bei, insbesondere von lncRNAs, die bei Bauchspeicheldrüsenkrebs eine Rolle spielen, war an der Nutzung des therapeutischen Werts von ncRNAs in der Tumortherapie beteiligt und entschlüsselte das Zusammenspiel von lncRNAs und pro-onkogenen RBPs bei solidem Krebs.
Die Rolle von RBPs bei Leukämie und soliden Krebsarten ist das Hauptforschungsinteresse der Labore Bley, Höll und Hüttelmaier. Die Höll-Gruppe berichtete über Mechanismen, die der Rolle von RBPs bei Leukämie zugrunde liegen, und untersuchte RBP-RNA-Interaktionsnetzwerke in Krebsmodellen. Konservierte pathophysiologische Mechanismen und das therapeutische Potenzial von onkofetalen RBPs bei soliden Krebserkrankungen sind das Kernforschungsthema der eng zusammenarbeitenden Gruppen von Bley (geb. Stöhr) und Hüttelmaier. Kürzlich haben sich diese Arbeitsgruppen mit dem Sinz-Labor zusammengetan, um wesentliches Know-how in der Massenspektrometrie bereitzustellen, um RBP-Protein-Interaktionsnetzwerke zu entschlüsseln und posttranslationale Proteinmodifikationen zu untersuchen. Ein wichtiger Beitrag dieser gemeinsamen Bemühungen ist die Charakterisierung von konserviertem N6-Methyladenosin (m6A) und weitgehend miRNA-abhängigen Mechanismen, die der RBP-gesteuerten Stimulation der Onkogenexpression, Krebszellmigration, -invasion und -metastasierung zugrunde liegen. Neben einem bemerkenswerten Potenzial von onkofetalen RBPs in der Krebsdiagnose begannen die Gruppen von Hüttelmaier und Bley auch, die therapeutischen Aussichten der Hemmung von RBPs (RBPi) zu untersuchen. Diese Studien zeigten die Antitumoraktivität von RBPi durch kleine Moleküle und Synergien von RBPi mit Kinasehemmung. Die Entwicklung neuer und die Verbesserung früher bekannter RBP-Inhibitoren beruht im Wesentlichen auf interdisziplinären Struktur-Aktivitäts-Relation (SAR)-gesteuerten Ansätzen. Dazu hat sich das Labor Hüttelmaier mit den Laboren Balbach und Sippl zusammengeschlossen. Diese bieten komplementäre Expertise in der biophysikalischen Charakterisierung von Proteinfaltung und Protein-Ligand-Wechselwirkung durch NMR (Balbach) sowie dem Design und der Synthese von PROTACs (Proteolysis Targeting Chimera) sowie niedermolekularen Inhibitoren (Sippl). Diese gemeinsamen Studien führten bereits zu RBPi-Verbindungen mit überlegener Anti-Tumor-Aktivität (angemeldete Patente: EP20211807.1; EP20159945.3).