Zellbiologische Ansätze bei psychiatrischen Erkrankungen
Neben der sehr erfolgreichen Weiterführung der Genomics, Omics und Phänomics-Studien werden zellbiologische Ansätze unter Verwendung primärer neuronaler Kulturen und adulter Stammzellen verfolgt, die zur Aufklärung glutamaterger und serotonerger Mechanismen bei neuropsychiatrischen Erkrankungen eingesetzt werden und interessante Hinweise auf pathophysiologische Zusammenhänge ergeben. Routinemäßig werden EBV-transformierte Zelllinien sowie primäre Fibroblasten hergestellt. Für die Differenzierung Patienten-spezifischer Neurone werden episomale Reprogrammierungsvektoren verwendet. Die Herstellung dieser Zelllinien wird durch molekularbiologische Methoden wie z.B. Durchflusszytometrie, Immunofluoreszenz-Analyse, Westernblot überprüft. Aus den Stammzellen werden z.B. reife GABAerge Zellen hergestellt. Darüber hinaus werden Organkultursysteme, sogenannte gehirnähnliche Organoide oder Mini-Brains angelegt. Die Analyse der Patienten-spezifischen Nervenzellen zielt darauf ab, gewonnene genetische Varianten hinsichtlich ihrer Funktion genauer zu charakterisieren.
- Benninghoff J, Rauh W, Brantl V, Schloesser RJ, Moessner R, Möller HJ, Rujescu D. (2013) Cholinergic impact on neuroplasticity drives muscarinic M1 receptor mediated differentiation into neurons. World J Biol Psychiatry. 2013 Apr;14(3):241-6.
- Benninghoff J, Grunze H, Schindler C, Genius J, Schloesser RJ, van der Ven A, Dehning S, Wiltfang J, Möller HJ, Rujescu D. (2013) Ziprasidone - Not Haloperidol - Induces more de-novo Neurogenesis of Adult Neural Stem Cells Derived from Murine Hippocampus. Pharmacopsychiatry. Jan;46(1):10-5.
- Yoon KJ, Nguyen HN, Ursini G, Zhang F, Kim NS, Wen Z, Makri G, Nauen D, Shin JH, Park Y, Chung R, Pekle E, Zhang C, Towe M, Hussaini SM, Lee Y, Rujescu D, St Clair D, Kleinman JE, Hyde TM, Krauss G, Christian KM, Rapoport JL, Weinberger DR, Song H, Ming GL. (2014) Modeling a genetic risk for schizophrenia in iPSCs and mice reveals neural stem cell deficits associated with adherens junctions and polarity. Cell Stem Cell. 2014 Jul 3;15(1):79-91.
- Genius J, Schellenberg A, Tchana-Duope L, Hartmann N, Giegling I, Hartmann A, Benninghoff J, Rujescu D. (2015) Enhanced calcium responses to serotonin receptor stimulation in T-lymphocytes from schizophrenic patients. -A pilot study. Neurosci Lett. Mar 4;589:159-62.
Die Genetik und Neurobiologie psychiatrischer Erkrankungen wird in unserer Arbeitsgruppe unter anderem auch mit Stammzellmodellen genauer untersucht. Dabei stehen Patienten mit Schizophrenie, suizidalem Verhalten, kognitiven Störungen, und Demenzen besonders im Vordergrund.
Stammzellmodelle dienen unter anderem der Analyse des Verlaufs und der Behandlung von Erkrankungen und werden in pharmakologischen Studien (z.B. Thalidomid) und autologen Zellersatz-Therapien eingesetzt. Sie können als Modell realitätsnaher, zellulärer Verbände in der Grundlagenforschung zur Aufklärung von pathophysiologischen Mechanismen verwendet werden.
Was sind pluripotente Stammzellen?
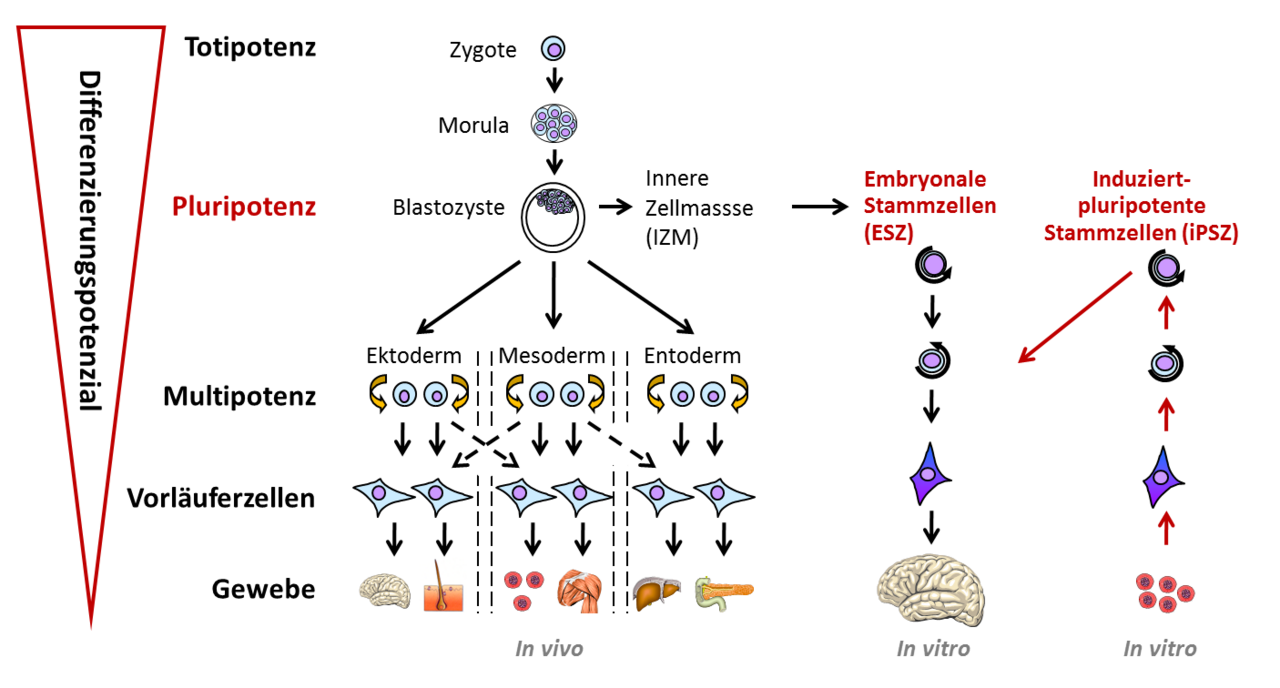
Embryonale Stammzellen (ES-Zellen) der Maus und des Menschen sind pluripotent. Das bedeutet, dass sie zum einen in der Kulturschale nahezu unbegrenzt vermehrbar sind und zum anderen die Fähigkeit haben, in alle Zellen des Körpers differenzieren zu können. Die induziert-pluripotenten Stammzellen (iPS-Zellen) sind den embryonalen Stammzellen sehr ähnlich. So besitzen diese Zellen ebenfalls das Potential, alle Zellen des Körpers hervorzubringen und sind nahezu unbegrenzt vermehrbar. Jedoch werden iPS-Zellen nicht aus Embryonen, sondern aus gereiften Körperzellen wie den Blutzellen gewonnen. Dabei werden bestimmte Stammzell-spezifische Gene angeschaltet, sodass diese Körperzellen in den Zustand der Pluripotenz versetzt werden.
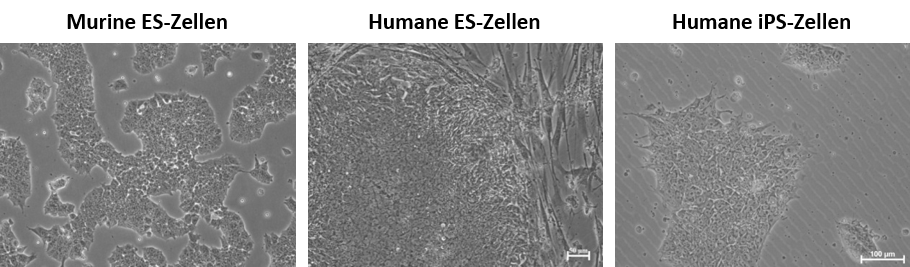
Pluripotente Stammzellen haben eine flache, epithelartige Morphologie. Sie wachsen in Kolonien und sind besonders klein. Die nachstehende Abbildung zeigt murine ES-Zellen auf einer Gelatine-Beschichtung, humane ES-Zellen auf einer ernährenden Zellschicht aus Fibroblasten und humane iPS-Zellen auf einer Beschichtung aus extrazellulären Matrixproteinen.
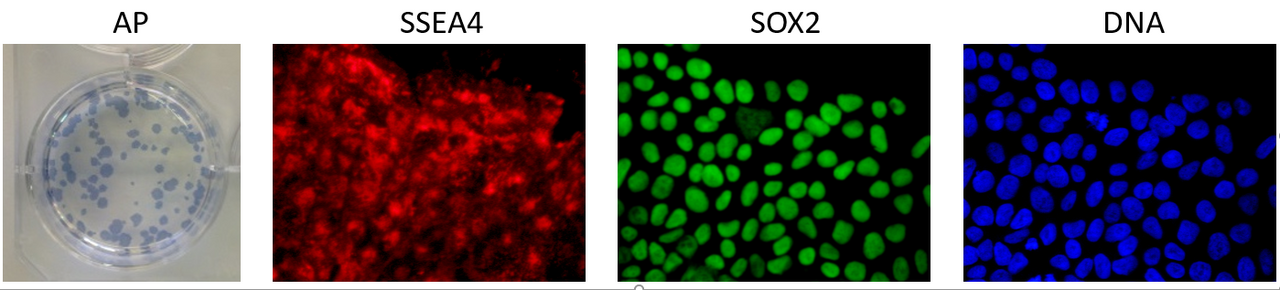
Ein Erkennungsmerkmal pluripotenter Stammzellen ist die Aktivität alkalischer Phosphatasen (AP). Die nachstehende Abbildung zeigt den histologischen Nachweis, der zu einem blauen Farbumschlag in Zellen mit aktivierter AP führt. Die hochauflösende, konfokale Mikroskopie wurde in der nachstehenden Abbildung genutzt, um die Expression Pluripotenz-spezifischer Proteine in einzelnen Zellen nachzuweisen: Die Oberflächenmodifikation Stage-Specific Embryonic Antigen 4 (SSEA4), ein Zellkern-lokalisierter Transkriptionsfaktor (SOX2), und die DNA des Zellkerns sind dargestellt.
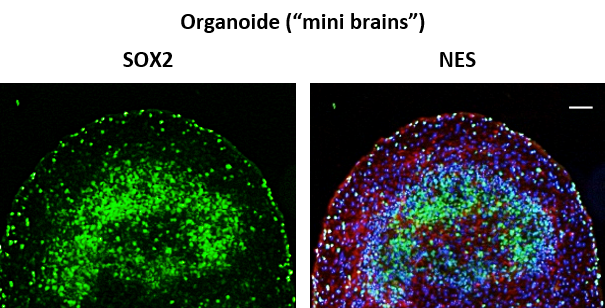
Des Weiteren ist es möglich, differenzierte cerebrale Kulturen auch in 3D herzustellen. Diese Kulturen (Organoide oder „mini brains“) zeichnen sich durch die Bildung cerebraler Strukturen aus, die der Schichtung des menschlichen Cortex sehr ähnlich sind. Die nachstehende Abbildung zeigt Kryoschnitte und eine anschließende Immunfluoreszenz-Färbung (NES, SOX2) zusammen mit einer DNA-Färbung.
Wie werden induzierte pluripotente Stammzellen hergestellt?
Die Herstellung von iPS-Zellen ist am effizientesten, wenn Retroviren als Vektoren eingesetzt werden. Der Retrovirus integriert in das Genom der somatischen Zellen und enthält Gene, die dann durch den Wirt abgelesen werden und die Eigenschaft Pluripotenz induzieren. Die Genexpression der fremden DNA führt zur Umwandlung in die iPS-Zelle. Dauerhafte Veränderungen des Genoms sind dabei möglich und wahrscheinlich. Die fremde DNA wird von der Zelle erkannt und stillgelegt. Jedoch kann die Expression der eingebrachten Gene nicht sicher unterbunden werden, was eine Aktivierung krebsfördernder Onkogene zur Folge hat. Weiterhin kann die Integration in das Genom das Verhalten der Zelle stark beeinflussen.
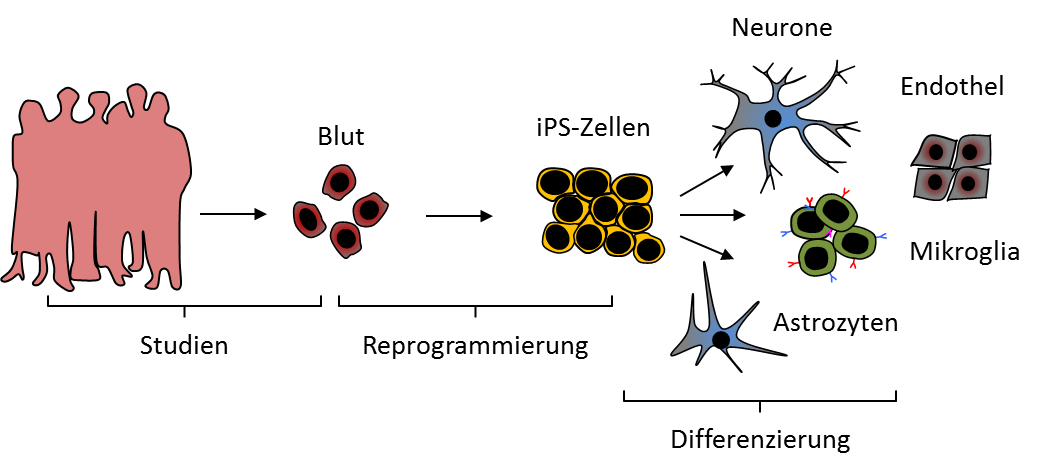
Gerade in Hinsicht auf die Untersuchung von DNA-Variationen ist jedoch ein intaktes Genom erforderlich. Aus diesem Grund werden für genetische Fragestellungen keine Retroviren verwendet, sondern modifizierte Plasmide, RNA-Moleküle oder RNA-Viren als Vektoren eingesetzt. Diese sind allerdings weitaus weniger effizient und nicht für jeden Zelltyp geeignet. Für die Reprogrammierung können eine Reihe von Ausgangszelltypen verwendet werden. In der Vergangenheit waren dies in vielen Studien Fibroblasten aus der Haut. Es ist jedoch auch möglich, leichter zugängliche Zellen, wie Blutzellen, zu reprogrammieren.
Können aus pluripotenten Stammzellen Neurone oder andere Zellen hergestellt werden?
Auch wenn die pluripotenten Stammzellen die Eigenschaft besitzen, in alle Zellen des Körpers zu differenzieren, ist es schwierig, die richtigen Zellkulturbedingungen für jeden Zelltyp zu finden. Es ist jedoch möglich, durch spezielle Kulturbedingungen die Differenzierung in eine gezielte Richtung zu lenken und Neurone, Astrozyten, Mikroglia oder Endothelzellen der Bluthirnschranke herzustellen.
Pluripotente Stammzellen können in einem ersten Schritt in einen sogenannten Embryoidbody (EB) differenziert werden. Die Zellen werden dabei in einem hängenden Tropfen kultiviert und ballen sich zu einem kugelförmigen Zellaggregat zusammen. Die so erzeugte Zellformation soll das Stadium der Blastula nachahmen. Die daraus hervorgehenden Vorläuferzellen können sich in alle differenzierten Zellen der drei Keimblätter Mesoderm, Ektoderm und Entoderm umwandeln. Durch Gabe von Wachstumsfaktoren kann der Anteil der Vorläuferzellen an dem jeweiligen Keimblatt gesteuert werden.

Warum sind iPS-Zellen für die psychiatrische Forschung interessant?
Es ist bekannt, dass genetische Variationen die Entstehung psychiatrischer Erkrankungen begünstigen oder deren Verlauf entscheidend beeinflussen können, wobei die funktionelle Konsequenz meist jedoch noch unklar ist. Es ist demnach von Interesse, diese genetischen Variationen genauer zu untersuchen. Die Information, dass eine genetische Variation mit einer Erkrankung in Zusammenhang steht, kommt meist aus großen genomweiten Assoziationsstudien, die zwar eine Aussage über die Wahrscheinlichkeit des Zusammenhangs machen, jedoch keinen Nachweis einer funktionellen Konsequenz führen können. Zusätzlich ist die hoch polygene und multifaktorielle Natur psychiatrischer Erkrankungen ein schwierig einzugrenzender Bereich. Für die häufig untersuchten Einzelbasenaustausche (single nucleotide polymorphisms, SNPs) ist zudem bekannt, dass sie in der Regel nur sehr kleine Effekte aufweisen und erst in einer Anhäufung von Risikovarianten und in Kombination mit Umweltfaktoren den Ausbruch einer Erkrankung begünstigen. Die ebenfalls häufig untersuchten Kopieanzahlvariationen (copy number variations, CNVs) sind sehr viel seltener, weisen aber wesentlich größere Effekte auf. Die funktionelle Auswirkung ist jedoch für beide Typen schwer vorherzusagen, weil die Auswirkung von SNP-Varianten auf funktioneller Ebene meist aufgrund ihrer Lage in Intergenregionen oder Introns indirekt oder unbekannt ist (i.e. assoziierter Bereich zu klein, um eindeutig auf ein Gen hinzuweisen), während bei den CNVs meistens mehrere bis viele Gene von der Duplikation oder Deletion betroffen sind (i.e. assoziierter Bereich zu groß, um eindeutig auf ein Gen hinzuweisen), sodass die Auswirkung hier auf mehrere Gene zurückzuführen sein könnte.
Für die Untersuchung der funktionellen Auswirkung von mit psychiatrischen Erkrankungen assoziierter Gene ist es also notwendig, auf Basis der Assoziationsstudien Risikovarianten auszuwählen, die auf einem möglichst authentischen genetischen Hintergrund untersucht werden können. Dieser Aufgabe gehen wir nach, indem wir patientenspezifische iPS-Zellen zur Analyse verwenden. Für die Etablierung der iPS Zelllinien werden Patienten ausgewählt, auf deren chromosomaler DNA interessante Risikovarianten zu finden sind, wie z.B. CNVs oder SNPs in Protein-kodierenden Regionen, sowie Kontrollen, die bis auf die aktuell bekannten Risikoloci einen möglichst ähnlichen genetischen Hintergrund besitzen. Werden die probandenspezifischen iPS-Zellen anschließend in Neurone oder Gliazellen differenziert, besteht die Möglichkeit, erkrankungsspezifische Veränderung in der Zellkultur nachzuvollziehen und ggf. zu manipulieren.