Intermediäre Phänotypen
Durch Familien-, Zwillings- Adoptionsstudien wurde zweifelsfrei für viele psychische Erkrankungen eine genetische Veranlagung nachgewiesen, die Suche nach den dafür verantwortlichen Genen erwies sich jedoch als zunehmend komplex.
Einer der Gründe dafür dürfte darin liegen, dass klinische Klassifikationssysteme psychiatrischer Erkrankungen, wie auch das für die Schizophrenie, heterogene Störungen mit einzelnen Subtypen zu beschreiben scheinen. Damit dürfte die gebräuchliche klinisch-psychiatrische Klassifikation für genetische Studien nicht immer optimal geeignet sein. Ein weiterer Grund liegt in dem Abstand zwischen der chromosomalen und der Verhaltensebene, der eine bislang nicht überschaubare Anzahl an Variationsmöglichkeiten bietet, die die Ausprägung eines Phänotyps beeinflussen können.
Ein Versuch, diese Komplexität in den Griff zu bekommen, wurde durch den Entwurf des Konzepts der Endophänotypen unternommen, das psychische Störungen als Kombination verschiedener neurobiologischer Prozesse auffasst. Diese Prozesse sind zwischen der genetischen Ebene, die einen direkten Einfluss auf die Funktion von Zellen und Zellverbänden aufweist, und der Ebene psychopathologisch definierter psychiatrischer Diagnosen anzusiedeln und sollten folgende Eigenschaften aufweisen:
- Gehäuftes Auftreten im Rahmen der Erkrankung
- Eigene genetische Komponente
- Auftreten auch außerhalb eines akuten Krankheitsschubs
- Vorhandensein vor der Erstmanifestation
- Korrelation innerhalb der biologischen Angehörigen
Quantitative und kontinuierliche Verteilung
Endophänotypen können mit den Ursachen einer psychiatrischen Erkrankung näher assoziiert sein und diese besser umschreiben als der klinische Phänotyp und repräsentieren eine Verbindung zwischen Genen und dem klinischen Phänotyp. Aus diesem Grund erscheint eine Einteilung nach Endophänotypen, denen einfache, quantitative Messgrößen neuropsychiatrischer Funktionen zugrunde liegen, bei der Identifizierung relevanter Gene vielversprechend. Dieser Ansatz ermöglicht es, die mit ätiologischen Modellen einhergehenden methodischen Probleme zu umgehen.
Die für die Analyse von Endophänotypen der Schizophrenie zur Verfügung stehenden Methoden beinhalten neurophysiologische, neuropsychologische und bildgebende Verfahren. Einige dieser Endophänotypen sind unabhängig vom Erkrankungsstadium mit der Krankheit assoziiert und kosegregieren in betroffenen Familien. Zusätzlich zur Gewinnung genetischen Materials ist daher die exakte Definition von Endophänotypen und der Aufbau einer multimodalen Phänotypbank für die nachgeschalteten Analysen essentiell und bedarf einer ständigen Überarbeitung und Erweiterung.
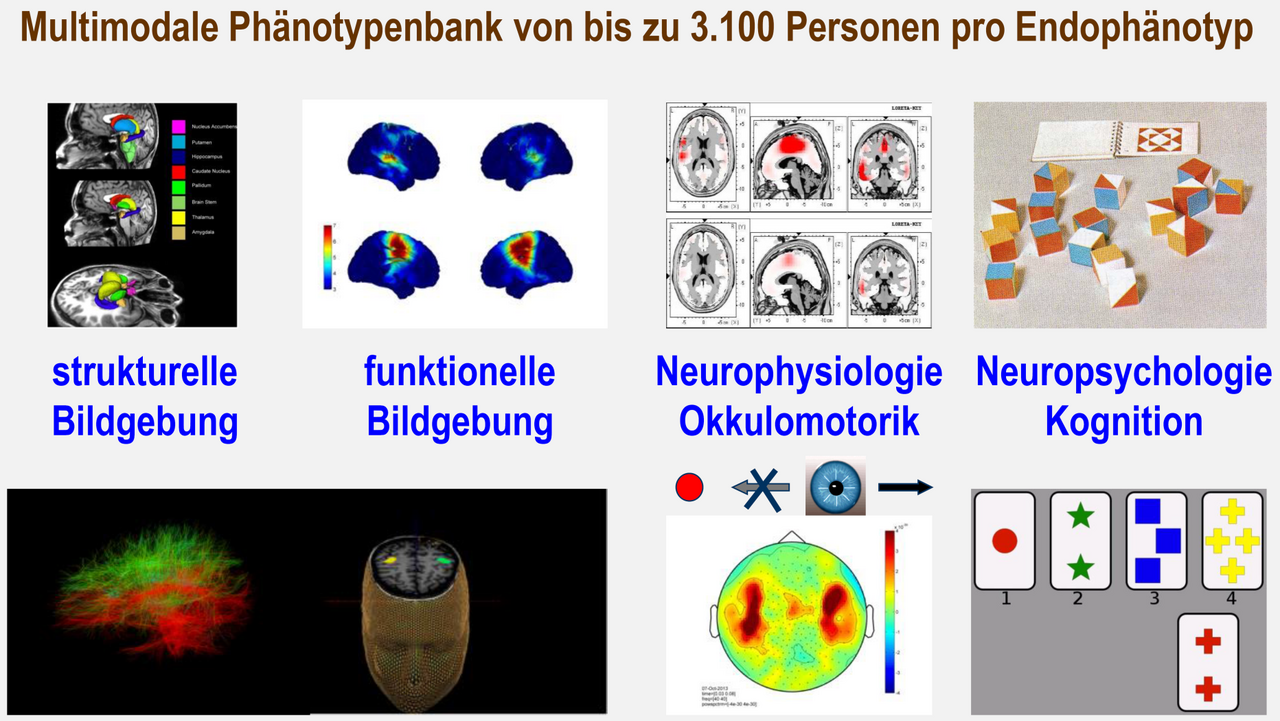
Vergleichbare Stichproben u.a. mit intermediären Schizophrenie-assoziierten Phänotypen aus den Bereichen Hirnstruktur, Neurophysiologie und Kognition sind weltweit in nur wenigen weiteren Zentren vorhanden, mit denen reger wissenschaftlicher Austausch und Kooperationen bestehen.
So konnten in Zusammenarbeit mit dem National Institutes of Health (NIMH) eine primatenspezifische Isoform eines Kaliumkanalgens (KCNH2) identifiziert werden, dessen Risikoallel neben der Schizophrenie u.a. mit Gedächtnisleisung, IQ, Verarbeitungsgeschwindigkeit sowie Hippocampusphysiologie und -struktur assoziiert ist (Huffaker et al. 2009).

Huffaker SJ et al. (2009) A primate-specific, brain isoform of KCNH2 affects cortical physiology, cognition, neuronal repolarization and risk of schizophrenia. Nat Med. May; 15(5): 509-18.
Ein reduziertes Volumen des Hippocampus, welcher als Schnittstelle zwischen Lang- und Kurzzeitgedächtnis hauptverantwortlich für die Gedächtniskonsolidierung zuständig ist, wird bei einer Reihe von psychischen Erkrankungen, die mit kognitiven Defiziten einhergehen, wie z.B. der Alzheimer Demenz und der Schizophrenie, beobachtet. In einer großen Metaanalyse konnte gezeigt werden, dass häufig auftretende genetische Variationen mit dem Volumen des Hippokampus (TESC1) und des Interkraniums (HMGA2) in gesunden Probanden assoziiert sind (Stein et al. 2012). Von deren weiterer Charakterisierung erhofft man sich Einblicke in möglicherweise pathologische Veränderungen bei kognitiven Defiziten.

Stein JL et al. (2012) Identification of common variants associated with human hippocampal and intracranial volumes. Nat Genet. Apr 15; 44(5): 552-561.
Im Rahmen fortlaufender genetischer Analysen erwiesen sich die Endophänotypen i.d.R. ebenfalls als äußerst komplex, polygen und mit sehr geringen Effekten für einzelne Varianten behaftet, so dass auch hier eine ständige Erhöhung der Stichprobenzahl angestrebt wird, welche sich nur durch einen Zusammenschluss in großen Konsortien verwirklichen lässt.
Dazu wurde u.a. in einem NIH geförderten Antrag das Genetic Determinants of Schizophrenia Intermediate Phenotypes (GDSIP)/ Genetics of Endophenotypes of Neurofunction to Understand Schizophrenia (GENUS) Consortium gegründet, dessen Ziel die Aufklärung der biologischen Bedeutung mit Schizophrenie assoziierter genetischer Variationen ist. Dafür wurden mittlerweile über 10.000 Probanden aus breitgefächerten und gut charakterisierten Stichproben zusammengeführt und die Daten harmonisiert.
2012: National Institutes of Health: 1R01MH092380-01A1: “Genetic Determinants of Schizophrenia Intermediate Phenotypes (GDSIP/GENUS)”, PI: Prof. Petryshen, USA

Blokland et al. (2018) The Genetics of Endophenotypes of Neurofunction to Understand Schizophrenia (GENUS) consortium: A collaborative cognitive and neuroimaging genetics project. Schizophr Res. May:195:306-317.
In einer Metaanalyse eines weiteren Konsortiums, des Cognitive Genomics consorTium (COGENT), wurde 2014 erstmals die Endophänotyp-Hypothese zu kognitiven Defiziten in der Schizophrenie molekulargenetisch bestätigt. Diese besagt, dass Allele, die mit einer geringeren kognitiven Fähigkeit assoziiert sind, gleichzeitig das Risiko für Schizophrenie erhöhen. Unter Verwendung von polygenen Risikoscores für die Kognition konnte gezeigt werden, dass Schizophreniepatienten signifikant niedrigere Werte zeigten als klinisch unauffällige Kontrollen und die Scores für Schizophrenie mit geringeren allgemeinen kognitiven Fähigkeiten assoziiert waren (Lencz et al. 2014).

Lencz T et al. (2014) Molecular genetic evidence for overlap between general cognitive ability and risk for schizophrenia: a report from the Cognitive Genomics consorTium (COGENT). Mol Psychiatry. Feb:19(2):168-74.
In einer Nachfolgestudie an etwa 35.000 europäisch-stämmigen Probanden konnten genomweit signifikant assoziierte Variationen in den Genen CENPO und LOC10537885 (long intergenic non coding RNA) bestimmt werden. Genbasierte Analysen ergaben zusätzlich drei in kognitive Fähigkeiten involvierte Regionen auf den Chromosomen 17q21.31, 17p13.1 und 1p13.3. Des Weiteren konnten positive polygene Korrelation (gemessen mit LD score regression) zwischen kognitiver Leistung und Bildungsabschluss, Autismus und dem Persönlichkeitsfaktor Offenheit identifiziert werden, während Schizophrenie und Rauchen negativ korreliert waren (Trampush et al. 2017).

Trampush et al. (2017) GWAS meta-analysis reveals novel loci and genetic correlates for general cognitive function: a report from the COGENT consortium. Mol Psychiatry. Mar;22(3):336-345.
In einer großen Metaanalyse zur Intelligenz mit fast 270.000 Probanden, zu der neben vielen anderen auch das COGENT und GENUS Konsortium und damit auch unsere Proben einen Beitrag leisteten, ließen sich zusätzlich zu 24 bereits bekannten noch 190 weitere Loci, sowie 1016 Gene (939 neue) identifizieren. Durch weitere datenbankbasierte und statistische Untersuchungen ergaben sich Anreicherungen assoziierter SNPs in konservierten und kodierenden Regionen, sowie erstmals auch unter den Variationen, die zur Änderung der Aminosäurekodierung führen. Des Weiteren zeigten die assoziierten Gene überwiegend eine Expression im Gehirn, insbesondere in den striatalen mittelgroßen dornentragenden Projektionsneuronen und den Pyramidenzellen des Hippokampus und waren an Signalwegen der neuronalen Entwicklung und Differenzierung, sowie der Synapsenstruktur beteiligt. Des Weiteren konnten Hinweise auf einen protektiven Effekt von höherer Intelligenz für die Alzheimer Demenz und ADHD, ein erhöhtes Risiko für Autismus und ein bidirektionaler und demnach vermutlich pleiotropher Effekt für Schizophrenie beschrieben werden (Savage et al. 2018).

Savage et al. (2018) Genome-wide association meta-analysis in 269,867 individuals identifies new genetic and functional links to intelligence. Nat Genet. Jul;50(7):912-919.
Inzuchtdepression (Verringerung der reproduktiven Fitness einer Population) beruht auf einer erhöhten Autozygotie (d.h. autosomale Segmente oder Loci, die bei einer Person homozygot vorliegen und dieselbe Abstammung haben, z.B. durch Verwandtschaft der Eltern). Dadurch wird die Wahrscheinlichkeit erhöht, dass rezessive schädliche Mutationen zum Tragen kommen. In einer Stichprobe aus 4854 Probanden wurden auf der Basis von SNP Arrays chromosomale Segmente, die eine Reihe aufeinanderfolgender homozygoter SNPs enthielten, bestimmt, um den autozygoten Anteil des Gesamtgenoms zu schätzen. Dieser wurde anschließend zu genereller kognitiver Leistung in Beziehung gesetzt. Dabei zeigte sich, dass eine erhöhte „Last“ an Autozygotie eine niedrigere Intelligenz vorhersagt und dass dieser Effekt hauptsächlich aus den langen und seltenen autozygoten Bereichen herrührt. Einzelne chromosomale Bereiche mit hoher Autozygotie wiesen jedoch keinen prädiktiven Charakter für generelle kognitive Leistungen auf. Multiple rezessive oder partiell rezessive Allele scheinen dementsprechend bei der Kognition eine Rolle zu spielen (Howrigan et al. 2016).

Howrigan et al. (2016) Genome-wide autozygosity is associated with lower general cognitive ability. Mol Psychiatry. Jun:21(6):837-43.
Aus Studien zu genetischen, mit Intelligenzminderung einhergehenden Erkrankungen ist eine gehäufte Beteiligung in epigenetische Regulationsmechanismen involvierter Gene an der Kognition bekannt. Eine Untersuchung von acht derartigen Genen, die sich in den 2014 durch das PGC veröffentlichten 108 mit Schizophrenie assoziierten Regionen finden, ergab einen möglichen Zusammenhang des mit Schizophrenie assoziierten Risikoallels einer Variante des CHD7 Gens mit einem geringerem IQ und schlechterem episodischen Gedächtnis (Whitton et al. 2016).

Whitton et al. (2016) Cognitive analysis of schizophrenia risk genes that function as epigenetic regulators of gene expression. Am J Med Genet B Neuropsychiatr Genet. Dec;171(8):1170-1179.
Ein weiterer Ansatz zur Aufklärung der biologischen Bedeutung der mit Schizophrenie assoziierten Loci, bestand in der Selektion von Varianten, die sich Genen mit einem Einfluss auf die synaptische Transmission zuordnen ließen, und der nachfolgenden Überprüfung eines Zusammenhangs zu kognitiven Phänotypen. Auf diese Weise konnte ein Zusammenhang zwischen dem Schizophrenie-Risikoallel einer Variante im CACNA1A Gen und schlechteren Leistungen im Arbeitsgedächtnis, sowie verringerter funktionaler Konnektiviät zwischen dem rechten dorsolateralen präfrontalen Kortex und verschiedenen kortikalen Regionen gefunden werden (Cosgrove et al. 2017).
Cosgrove et al. (2017) Cognitive Characterization of Schizophrenia Risk Variants Involved in Synaptic Transmission: Evidence of CACNA1C's Role in Working Memory. Neuropsychopharmacology. Dec;42(13):2612-2622.
